Eine Schwangerschaft dauert im Schnitt 38 Wochen. 38 Wochen, in denen ein kompletter Mensch entsteht. Arme, Beine, Knochen, Haut und Haare, Herz, Lunge und Gehirn. Verschiedene Organe und Gewebe.
"Mitte der dritten Woche sind wir eineinhalb bis zwei Millimeter lang. Ich kann nur staunen, dass in diesen zwei Millimetern schon der Keim für all das vorhanden ist, was wir sein werden." Nach zwei Wochen macht die Anlage des Nervensystems uns zu Individuen. Nach vier haben wir Oben, Unten, Links und Rechts. Nach fünf Wochen schlägt das Herz.
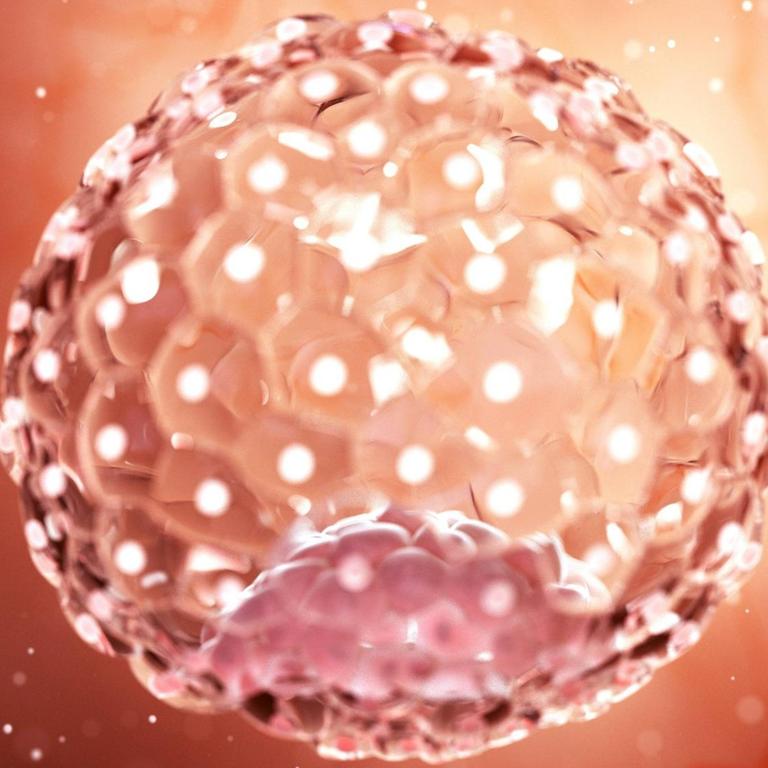
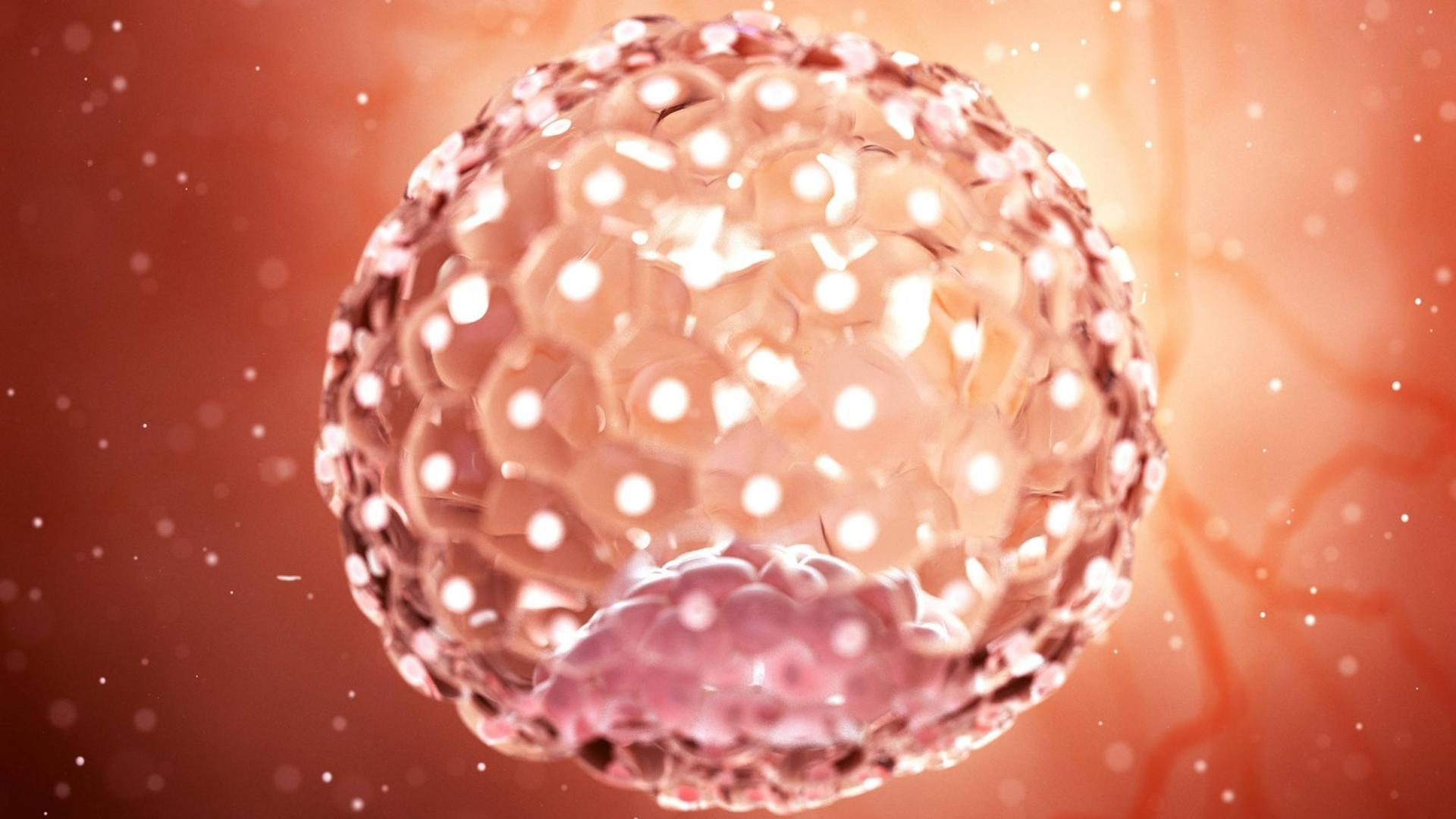
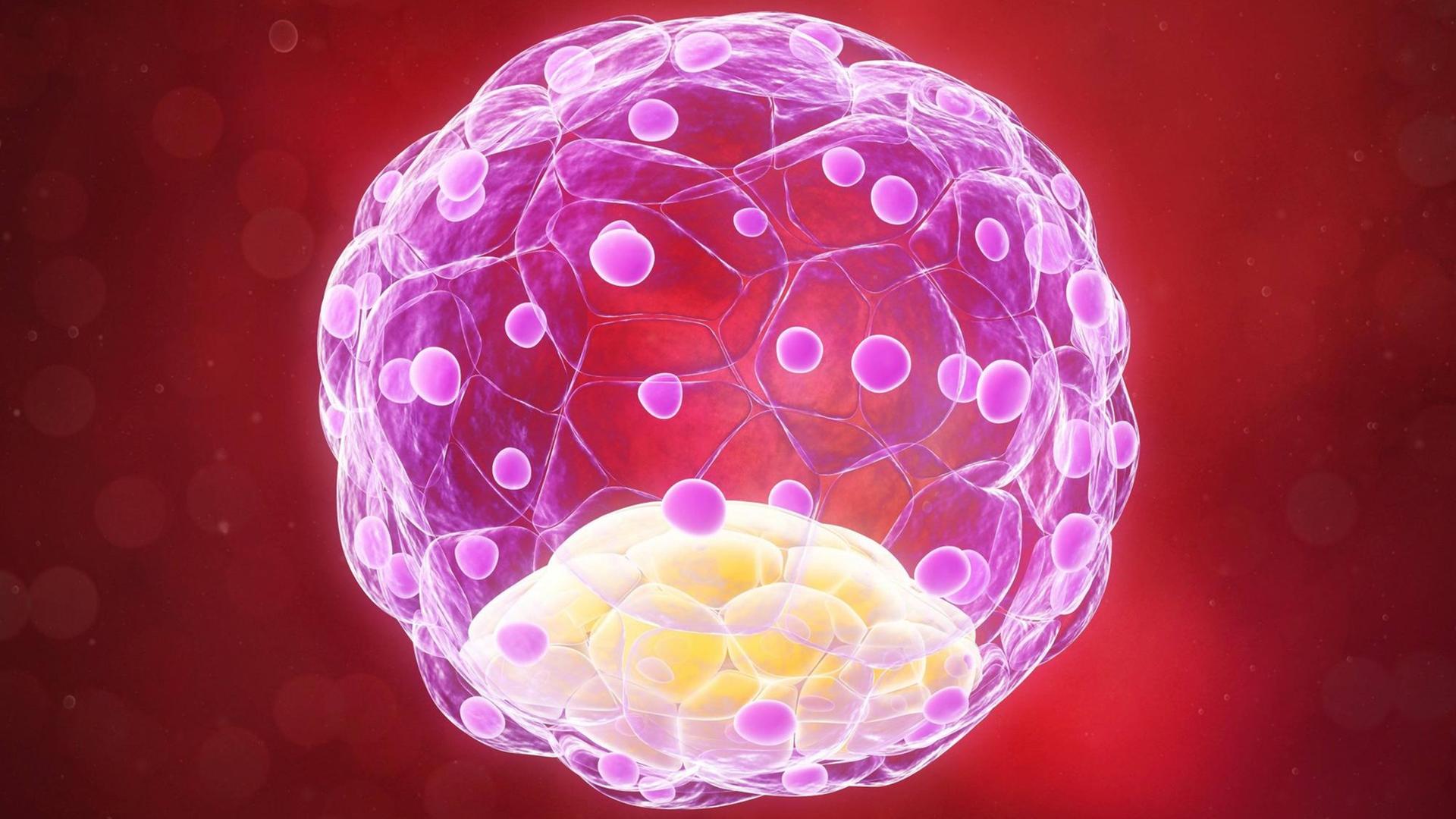
"Was ich hier sehe, ist ein Blastozyst, der sich schon ausgedehnt hat und aus seiner Schutzhülle herausgeschlüpft ist. Er sieht aus wie ein Hohlraum mit einem kleinen Klümpchen Zellen darin, die an einer Seite sitzen." Ob aus wenigen Zellen ein ganzer, gesunder Mensch wird, entscheidet sich schon ganz am Anfang eines Lebens. Hier liegen die Gründe für frühe Fehlgeburten und schwere Krankheiten. Aber auch die Hoffnung wächst, sie bald verhindern zu können.
"Verbrauchende Embryonenforschung" in England erlaubt
"Es entwickelt sich tatsächlich gerade sehr viel in diesem Bereich." In Deutschland ist die sogenannte verbrauchende Embryonenforschung verboten. In England aber ist sie bis zum Tag 14 erlaubt. Eine Aufsichtsbehörde vergibt die Lizenzen. Und eine solche Lizenz hat am Francis-Crick-Institut in London die Arbeitsgruppe von Kathie Niakan.
Sophie Brumm ist hier Doktorandin. Sie steht in einem fensterlosen Raum, vollgestellt mit Brutschränken, Mikroskopen, und sterilen Laborbänken für die Arbeit mit den Embryonen. "In diesem Stickstofftank, der mit einem Schloss gesichert ist, lagern wir die menschlichen Embryonen, die wir als Spende von Kinderwunsch-Kliniken bekommen haben. Sie sind in kleinen Plastikstrohhalmen im flüssigem Stickstoff eingefroren. Und hier können wir sie auftauen."
Es sind überzählige Embryonen aus Kinderwunschbehandlungen. Kathy Niakan: "Die meisten Paare nehmen große Mühen auf sich, um diese Embryonen für die Forschung zu spenden. Weil sie wissen, dass nur weitere Forschung die Effizienz der In-vitro-Fertilisation verbessern kann. Sie selbst haben auch von der Embryonenforschung profitiert. Deshalb haben die meisten das Gefühl, etwas zurückgeben zu wollen. Es ist Material, das sonst zerstört werden würde."
Untersuchungen nur bis zum Tag 14 zulässig
"Das hier sind zum Beispiel die Strohhalme und die Behälter, in denen die Strohhalme gelagert werden." "Wie groß ist denn so ein Embryo?" "Deutlich kleiner, als man denken würde. Zwischen 200 und 300 Mikrometer im Durchmesser. So klein sind sie. Man kann sie in einer Flüssigkeit gerade so mit dem Auge erkennen."
Im Labor dürfen sie nur so lange untersucht werden, bis sie ein Alter von 14 Tagen erreicht haben. Dann wird ihre Entwicklung gestoppt. An den Moment, als sie zum ersten Mal mit einem humanen Embryo gearbeitet hat, kann sich Sophie Brumm noch gut erinnern:
"Es ist einschüchternd - weil das Material, mit dem man arbeitet, so unglaublich kostbar ist und wir so wenige Embryonen zur Verfügung haben. Jedes einzelne zählt und deshalb muss man sich jedes Experiment, das man plant, wirklich gründlich überlegen, um das Maximum an Informationen herauszuholen. Es ist nicht wie mit Mäuseembryonen, wo man hunderte gleichzeitig verwenden kann. Es sind wirklich immer nur ein bis zwei. Und wenn man die von einer Petrischale in eine andere überführt, muss man wirklich sicher sein. Das verursacht richtiges Herzklopfen."
Ein kleiner Teil der Zellen hat besonderes Potenzial
Kathy Niakan: "Wir konzentrieren uns auf die ersten sieben Tage der menschlichen Entwicklung, also ab dem Zeitpunkt, an dem eine Eizelle von einem Spermium befruchtet worden ist. Am ersten Tag ist es ein Embryo mit zwei befruchteten Vorkernen, am zweiten Tag teilt er sich in zwei Zellen und so weiter. Bis sich ein kleiner Ball aus etwa 200 Zellen bildet, der Blastozyste genannt wird.
In diesen sieben Tagen hat sich der Embryo noch nicht in der Gebärmutter eingenistet. Fehler können jetzt fatale Auswirkungen haben. Wird das falsche Gen zur falschen Zeit aktiv, kann die Schwangerschaft frühzeitig enden.
"Von diesen 200 Zellen, die den Blastozyst bilden, hat nur ein kleiner Teil - sieben bis zehn Zellen vielleicht - das einzigartige Potenzial, den kompletten Fötus entstehen zu lassen. Deshalb untersuchen wir die molekularen Eigenschaften dieser sieben bis zehn von 200 Zellen."
Experimente mit der Genschere CRISPR/Cas9
Sophie Brumm: "Was man hier an der Seite sehen kann, sind kleine Pipetten und Steckplätze, an denen man weitere Pipetten für die Injektion anbringen kann. Mit denen kann man den Embryo manipulieren, etwas in einzelne Zellen hineinspritzen und so Experimente machen."
An diesem Gerät wurden auch Kathy Niakans bisher wichtigste Experimente durchgeführt. Mit der Genschere CRISPR/Cas9 hat sie gezielt ein Gen in den Zellen menschlicher Embryonen ausgeschaltet, das die Bauanleitung für das Protein Oct4 enthält. "Dieses Protein wird seit vielen, vielen Jahren in der Maus untersucht. Deshalb wissen wir: Wenn wir Oct4 inaktivieren, dann läuft in der Maus die Entwicklung der Plazenta nicht richtig ab."
Ohne das Protein bilden sich im Mäuseembryo Plazentazellen an Stellen, an denen sie eigentlich nicht sein dürften. Doch bei den Versuchen mit menschlichen Embryonen haben Kathy Niakan und ihr Team etwas ganz anderes beobachtet. "Man schaltet das Gen aus und das Programm für die Plazenta läuft gar nicht mehr ab. Das zeigt uns, dass das Protein im Menschen extrem wichtig ist, weil es die Entwicklung der Plazenta einleitet. Das hätten wir in der Maus so nicht herausgefunden."
Forschung an Mausembryonen nur begrenzt auf Menschen übertragbar
Wie gut ist das Modell Maus dann überhaupt? "Wir wissen, dass es wichtige Unterschiede zwischen unseren Spezies gibt. Wir benutzen die Maus aber als Stellvertreterin, um unsere eigene Biologie zu untersuchen. Wenn etwas so anders ist, müssen wir das wissen, denn das ist eine wirklich entscheidende Information."
Nick Hopwood, Entwicklungsbiologe und Historiker an der Universität Cambridge: "Seit dem Beginn des 19. Jahrhunderts hat die Embryologie versucht zu verstehen, wie sich komplexe Körper aus einfachen Anfängen entwickeln. Und als Menschen sind wir natürlich besonders neugierig auf menschliche Körper. Das Problem dabei ist, dass es enorm herausfordernd ist, weil die menschliche Entwicklung in schwangeren Körpern verborgen ist."
Stattdessen forschte man an Tieren. Zuerst an Hühnern und anderen Nutztieren, dann vor allem an Mäusen. "Aber es gibt auch eine sehr lange Tradition unter Anatomen, was eben möglich war, mit menschlichem Material zu machen. Seit dem Ende des 18. Jahrhunderts haben Anatomen Material von Frauen gesammelt, die eine Abtreibung oder eine Fehlgeburt hatten."
Daraus entstanden Entwicklungsreihen und Schnittserien. "Aber es gab auch Dinge, die sie nicht tun konnten. Sie hatten zum Beispiel keine Präparate aus den ersten zwei Wochen der Entwicklung."
In-vitro-Fertilisation weckt Angst vor Missbrauch
Mediziner in den USA baten deshalb in den 1930er-Jahren Frauen, denen die Gebärmutter oder Eierstöcke und Eileiter entfernt werden sollten, in den Wochen vor dem Eingriff Informationen über ihren Zyklus sowie jeden Geschlechtsverkehr zu notieren. Fanden die Wissenschaftler in den entfernten Organen dann frühe Embryonen, konnten sie auf deren ungefähres Alter schließen.
"Sie konnten so eine Reihe von sehr frühen Embryonen sammeln, die zum Standard für die ersten zwei Wochen wurden. Sie werden heute noch häufig für Abbildungen in Lehrbüchern benutzt. Das ist ein Beispiel dafür, dass auf gewisse Weise schon viel getan worden war, bevor es die In-vitro-Fertilisation gab. Aber natürlich hat die In-vitro-Fertilisation die Dinge dann erheblich verändert."
Mit der neuen Technik kam auch die Angst vor Missbrauch. Anfang der 1980er-Jahre trat in England das Warnock-Komitee zusammen, um über eine Regulierung zu beraten. Nach ausgiebiger Diskussion entschied das Komitee, die Zeit, in der menschliche Embryonen im Labor kultiviert und untersucht werden dürfen, auf 14 Tage zu begrenzen. Ab diesem Zeitpunkt ist es nicht mehr möglich, dass aus einem Embryo zwei werden, also Zwillinge entstehen, denn mit dem sogenannten Primitivstreifen wird die Wirbelsäule angelegt. Der Embryo wird in diesem Moment zum Individuum.
14-Tage-Grenze war politischer Kompromiss
Doch das war nicht der wichtigste Grund für die Entscheidung. Andy Greenfield, Biologe und ehemaliges Mitglied eines Komitees der Human Embryology and Fertilization Agency, der britischen Regulierungsbehörde für den Umgang mit menschlichen Embryonen: "Es war eine politische Einigung. Es war keine klare moralische Linie und das sollte es auch gar nicht sein. Es war eine praktische und pragmatische Linie. Niemand sagt damit, dass ein 13 Tage alter Embryo überhaupt keinen moralischen Wert hat, während er am 15. Tag zum Beispiel eine Person ist. Es war außerdem ein Kompromiss, weil es zum einen Leute gab, die überhaupt keine Forschung an Embryonen zulassen wollten. Andere wollten umfangreiche Embryonenforschung. Deshalb der Kompromiss: ‚Wir sagen, dass ihr sie nur für 14 Tage kultivieren dürft.‘"
Josephine Johnston, Rechtswissenschaftlerin am Hastings Center, einer Bioethik-Organisation in Garrison, USA: "Ich denke, was für die Leute, die die 14 Tage damals begrüßt haben, reizvoll war, das war, dass sie sich wie eine Menge Zeit anfühlten. Gleichzeitig lagen sie gefühlt deutlich vor dem Zeitpunkt, an dem der Embryo aussieht wie eine Person, also wie ein menschliches Wesen mit Armen und Beinen, oder anderen Dingen, die Leute mit Föten oder Babies verbinden. Es fühlte sich an, als ob es lange davor war, und damit wie ein sicherer Ort."
Als sicher empfand man die Grenze aber auch aus einem anderen Grund: Sie war technisch gar nicht erreichbar. Andy Greenfield: "Sie wussten, dass in den späten 80ern niemand Embryonen länger als sieben oder acht Tage kultivieren würde. Sie haben gedacht, bis auf die absoluten Gegner, die klar unzufrieden waren und es immer noch sind, würde es alle anderen für viele Jahre zufrieden stellen. Und sie hatten recht."
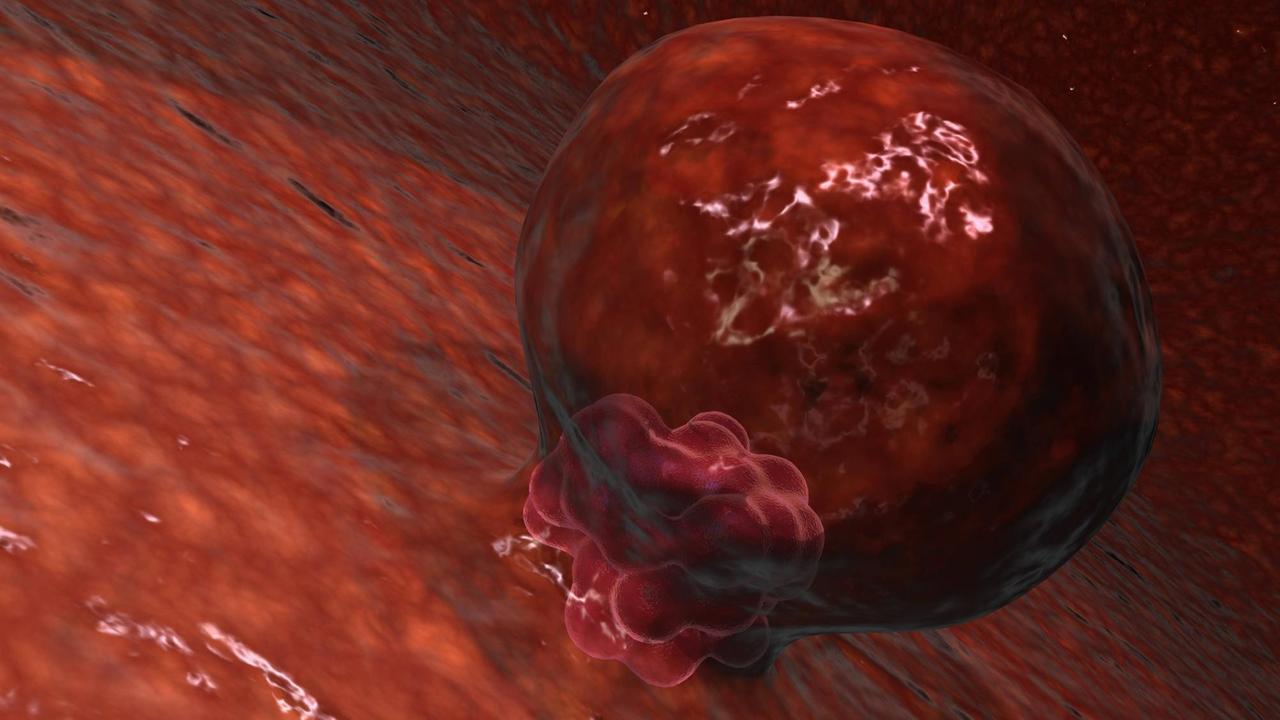
Einnistung löst Neuorganisation der Zellen aus
Am fünften oder sechsten Tag nach der Befruchtung beginnt der menschliche Embryo, sich in die Gebärmutterschleimhaut einzunisten. Scheitert die Einnistung, geht auch der Embryo verloren. Er braucht den Kontakt zum mütterlichen Gewebe, um sich richtig weiterzuentwickeln.
Martha Shahbazi vom MRC Laboratory of Molecular Biology, Cambridge: "Wenn der Embryo sich einnistet, verändert er seine Form wirklich komplett. Es findet eine massive Neuorganisation der Form der Zellen statt. Und das ist auch der Zeitpunkt, an dem die Zellen beginnen, Entscheidungen darüber zu treffen, wie sie sich weiterentwickeln. Diese beiden Dinge passieren zur gleichen Zeit."
Zu Beginn der Einnistung besteht eine Blastozyste aus gut 200 Zellen, nur ein kleiner Teil davon bildet später den Embryo. Aber wie wird das weitere Schicksal dieser Zellen festgelegt? Welche wird Muskel- welche Nervenzelle? Lange gab es keine Möglichkeit, diese Phase, die deshalb oft als "Black Box" bezeichnet wird, zu untersuchen. Bis vor etwa vier Jahren. Marta Shahbazi hatte kurz zuvor als Postdoc in der Arbeitsgruppe der Entwicklungsbiologin Magdalena Zernicka-Goetz an der Universität Cambridge angefangen. "Damals hatten sie dort gerade eine Methode entwickelt, um Mäuseembryonen über den Zeitpunkt der Einnistung hinaus zu kultivieren. Also war die nächste, naheliegende Frage: ‚Können wir dasselbe auch für menschliche Embryonen machen?‘ "
Um die Embryonen ohne Kontakt zu mütterlichem Gewebe über den Zeitpunkt der Einnistung hinaus wachsen zu lassen, versorgte man sie mit spezieller Nährlösung und bettete sie außerdem in ein gelartiges Medium ein. Und tatsächlich entwickelten sich die Embryonen in dieser Umgebung auf sich alleine gestellt weiter. Bis zum 13. Tag, und damit etwa eine ganze Woche länger, als das zuvor möglich war.
Forschung an Embryonen mit Chromosomenfehlern
Mittlerweile forscht Marta Shahbazi mit ihrer eigenen Arbeitsgruppe am MRC Molecular Biology Laboratory in Cambridge und hat wichtige Einsichten gewonnen. "Ein perfektes Beispiel dafür ist unsere Studie mit Embryonen, die Chromosomenanomalien haben. Wir können jetzt sehen, wie deren Entwicklung nach dem Blastozysten-Stadium abläuft."
Bei jeder Zellteilung müssen die Chromosomen, in denen die Erbsubstanz verpackt ist, auf die beiden neuen Zellen verteilt werden. Keines darf fehlen, keines zu viel sein. Chromosomenfehler stecken oft hinter frühen Fehlgeburten. Deshalb werden derart auffällige Blastozysten in Kinderwunschkliniken normalerweise vernichtet. Marta Shahbazi aber hat sie in ihr Labor geholt.
"Wir haben diese Embryonen also genommen und sie länger kultiviert und später zerschnitten und die Chromosomensätze der einzelnen Zellen untersucht. Bei den meisten haben wir die gleichen Ergebnisse wie in den früheren Untersuchungen gefunden, aber bei einigen gab es keine Übereinstimmungen zwischen der Diagnose im Blastozysten-Stadium und dem, was wir später beobachtet haben."
In einem besonders eindrücklichen Fall hatten alle untersuchten Zellen eines Embryos im Blastozysten-Stadium Chromosomenanomalien gezeigt. Als Marta Shahbazi und ihre Kolleginnen denselben Embryo später nochmal analysierten, konnten sie keine Abweichungen mehr finden. "Wie können wir das erklären? Vielleicht hat der Embryo die fehlerhaften Zellen während der Entwicklung beseitigt. Und dann hatte er auch das Potenzial, sich weiter zu entwickeln, denn er war die fehlerhaften Zellen losgeworden."
Genetische Untersuchungen nur begrenzt aussagekräftig?
Hinweise darauf, dass der frühe Embryo dazu in der Lage ist, gibt es bereits. Diese Fähigkeit wird als Plastizität bezeichnet und interessiert Marta Shahbazi besonders. Denkbar wäre aber auch, dass von Anfang an nicht alle Zellen des Embryos die gleiche Chromosomenstörung aufwiesen und bei der ersten Biopsie zufällig die kranken Zellen entfernt worden waren.
"Auf eine Art zeigt das auch, wie beschränkt die Aussagekraft ist, wenn Embryonen in diesem frühen Stadium genetisch untersucht werden. Es gibt eine riesige Debatte darüber, ob genetische Untersuchungen zu diesem Zeitpunkt gut sind oder nicht."
Marta Shahbazis Arbeit hat Möglichkeiten geschaffen, eine bisher unzugängliche Phase der menschlichen Entwicklung zu untersuchen und solche Fragen vielleicht zu beantworten. Sie ist aber auch der 14-Tage-Grenze so nahe gekommen wie niemand zuvor. Würde sie die Embryonen gerne noch länger untersuchen? "Ich finde, wenn man darüber nachdenkt, dass wir ja schon sieben extra-Tage dazubekommen haben, ist das ziemlich viel. Und es gibt so vieles, was wir mit diesen sieben Tagen anfangen können. Ich denke deshalb nicht, dass die 14-Tage-Regel sofort geändert werden muss. Aber es gibt natürlich auch Leute wie Alfonso, der sich für die Gastrulation interessiert. Die könnten wir an menschlichen Embryonen nicht untersuchen."
Der heikle Blick hinter die 14-Tage-Grenze
Alfonso, damit meint sie einen spanischen Kollegen, dessen Interesse jenseits der 14-Tage-Grenze liegt und damit auf verbotenem Terrain. Alfonso Martinez-Arias: "Mich begeistert es, dass nach fünf Wochen Entwicklung, wenn wir etwa ein bis zwei Millimeter lang sind, die Anlage für jedes beliebige Organ vorhanden ist und das Herz anfängt zu schlagen. Für zwei Millimeter ist das ziemlich bemerkenswert. Es ist der Keim für alles gelegt, was uns je ausmachen wird."
Alfonso Martinez-Arias hat 40 Jahre lang an der Universität Cambridge gearbeitet. Vor kurzem ist er mit seinem Labor nach Barcelona an die Universität Pompeu Fabra umgezogen. Wegen des Brexit, sagt er. Aber auch weil er in Spanien auf mehr Freiräume für seine Forschung hofft. Martinez-Arias untersucht die Gastrulation. Jenen faszinierenden Übergang zwischen der dritten und fünften Woche, bei dem der Embryo ein Vorne und Hinten bekommt, ein Oben und Unten, ein Links und Rechts. Da die Gastrulation sowohl nach der Einnistung als auch hinter der 14-Tage-Grenze liegt, lässt sie sich nicht an Embryonen im Labor untersuchen.
Alfonso Martinez-Arias hat sich gefragt, wie eine Alternative aussehen müsste. "Könnten wir einige der Vorgänge im Embryo nachempfinden? Und ich meine damit nicht nur, verschiedene Zelltypen entstehen zu lassen, sondern auch Strukturen herzustellen, die dem Embryo ähneln. Das hat unsere Forschung angetrieben. Denn wie gesagt, ist das die einzige Möglichkeit, Zugang zu diesen interessanten Stadien zu bekommen."
Gastruloide als Ersatz-Forschungsobjekte
Das Team ließ Stammzellen in verschiedenen Nährmedien wachsen, gab biochemische Signalmoleküle dazu - und wartete. "Und eines Tages haben wir dann diese Objekte gesehen. Sie haben Dinge getan, die der Gastrulation ähnelten und diese Strukturen mit drei Achsen ausgebildet, die so angeordnet waren, wie es charakteristisch ist für einen Embryo."
Auf den ersten Blick wirken die Gastruloide, wie Martinez-Arias sie nennt, unspektakulär. Kurze, dicke Würmer aus etwa dreihundert Zellen, an einem Ende leicht abgeknickt. Ihr Entwicklungszustand entspricht etwa dem eines Embryos in der dritten Woche. Alfonso Martinez-Arias konnte sie für bis zu 96 Stunden im Labor wachsen lassen. Zu einem kompletten Fötus könnten die Gastruloide sich nicht entwickeln, denn ihnen fehlen die Vorläufer der Nervenzellen, aus denen sich später das Gehirn entwickeln würde. Trotzdem bieten die Gastruloide neue Chancen für die Forschung. Wie entstehen Entwicklungsdefekte, angeborene Herzfehler zum Beispiel? Das könnte man in Gastruloiden besser untersuchen als in Organoiden, den seit einigen Jahren verfügbaren, aus Stammzellen gezüchteten Miniaturausgaben der jeweiligen Organe.
"Bestimmte Organe brauchen den Austausch: Sie müssen mit verschiedenen Geweben, verschiedenen Zelltypen sprechen. Das Herz ist ein sehr komplexes Organ. Erst wenn man alle Zutaten zusammenfügt, kann man sehen, wie sich seine Strukturen herausbilden. Ich glaube, das ist einer der Vorteile eines integrierten Organ-Systems. Wir brauchen ein System, das Interaktionen aller Organe zulässt."
14-Tage-Grenze für Stammzellmodelle aufgehoben
Dafür, dass der Bauplan des Menschen korrekt angelegt wird, reicht es nicht aus, dass die richtigen Gene zur richtigen Zeit aktiv sind. Entscheidend sind auch mechanische und chemische Stimuli. "So etwas können wir jetzt verstehen, weil die Gastruloide uns erlauben zu erforschen, was die Zellen spüren. Wir können die mechanischen und geometrischen Signale untersuchen, die Zellen brauchen, um sich selbst zu organisieren. Das war bisher nicht möglich."
Kann Alfonso Martinez-Arias mit den Gastruloiden alles tun, was er für sinnvoll hält – oder stößt auch er an ethische Grenzen? "Sehen sie, ein Flugsimulator ist kein Flugzeug. Es ist ein Simulator, der es erlaubt, Dinge zu tun, die man mit einem Flugzeug gar nicht erst machen wollen würde. Eben weil es kein Flugzeug ist."
Bisher galt für Embryoide wie für natürliche Embryonen die 14-Tage-Grenze. Erst im Mai 2021 hat die Internationale Gesellschaft für Stammzellforschung diese Beschränkung nun aufgehoben. Stammzellmodelle wie die Gastruloide aus Barcelona können jetzt unbegrenzt untersucht werden. Für Josephine Johnston eine kontroverse Entscheidung: "Je ähnlicher etwas einem menschlichen Embryo ist, in seiner Entwicklung, seiner Funktion und Form, desto wahrscheinlicher wird es die gleichen Bedenken hervorrufen. Mir ist klar, dass es ein inhärentes Problem ist, auf einem Kontinuum eine Linie zu ziehen, und ich habe keine elegante Lösung dafür. Aber in einer solchen Grauzone, wo etwas wie ein Embryo aussieht, aber eben nicht ganz – da fängt es wirklich an eine Rolle zu spielen, warum jemand denkt, dass die Forschung daran wichtig ist und was dadurch gewonnen werden könnte."
Embryonen-Modelle haben begrenzte Aussagekraft
Die Embryonenmodelle haben klare Vorteile. Doch sie haben auch Grenzen. Andy Greenfield: "Um zu beurteilen, wie repräsentativ sie sind, braucht es das echte Ding. Sonst sind wir in einer neuen Black Box, und wissen nicht, ob das, was wir sehen, überhaupt beispielhaft dafür ist, wie die Vorgänge im Uterus ablaufen."
Doch auch hier bröckelt der Widerstand. In ihren neuen Richtlinien regt die Internationale Gesellschaft für Stammzellforschung an, sich auch bei natürlichen Embryonen von der absoluten 14-Tage-Grenze zu verabschieden und stattdessen die andere Seite in den Blick zu nehmen, die der Fehlgeburten, schwerer Entwicklungsschäden oder Gendefekte, für die es eine Therapie geben könnte, wenn man denn forschen darf. Nach strengster Prüfung könnten Ethikkommissionen Projekte im Einzelfall genehmigen. Etwa um Ergebnisse aus der Forschung mit Gastruloiden oder anderen Embryoiden abzusichern. Sodass die Forschung mit solchen Embryo-Modellen voranschreiten kann.
Für Großbritannien kann sich Andy Greenfield vorstellen, schrittweise vorzugehen: "Man würde die gleichen Dinge tun müssen wie bisher. Also begründen, warum man menschlichen Embryonen braucht und nicht mit Tieren arbeiten kann. Warum man wie viele braucht und so weiter. Doch dann würde eine neue Box auftauchen, die von Anwälten sehr genau geprüft werden würde und die Frage wäre: ‚Wurden Experimente vorgeschlagen, die über Tag 14 hinausgehen?‘ Wenn man das mit ‚Ja‘ beantwortet, kämen eine Reihe gesetzlicher Voraussetzungen: Sind diese Experimente klar begründet? Wie sind sie begründet? Welche Art Forschung ist es, bei der klar ist, dass die Fragen nur nach dem 14. Tag beantwortet werden können?"
Diskurs über Embryonenforschung jenseits der 14-Tage-Grenze geht weiter
Mit dem Vorstoß der Internationalen Gesellschaft für Stammzellforschung dürfte auch in anderen Ländern ein politischer Prozess beginnen und ein gesellschaftlicher Diskurs. Denn welche Regeln gelten, darüber sollten nicht nur Wissenschaftlerinnen und Wissenschaftler diskutieren, findet Josephine Johnston:
"Forschung steht im Dienste der Gesellschaft, im Dienste des Fortschritts und im Dienste der Erkenntnis, und all diese Dinge müssen aneinander ausgerichtet werden. Sie sollten sich nicht entgegenstehen. Herauszufinden, wie man das macht, das ist schwierig. In der Embryonenforschung ist es besonders schwierig, denn wir befassen und hier mit frühesten Formen menschlichen Lebens. Aber mir scheint es absolut angebracht, dass wir unsere Aufmerksamkeit auf dieses Gebiet lenken. Es ist absolut richtig, dass wir alle zusammen sehr gründlich darüber nachdenken."