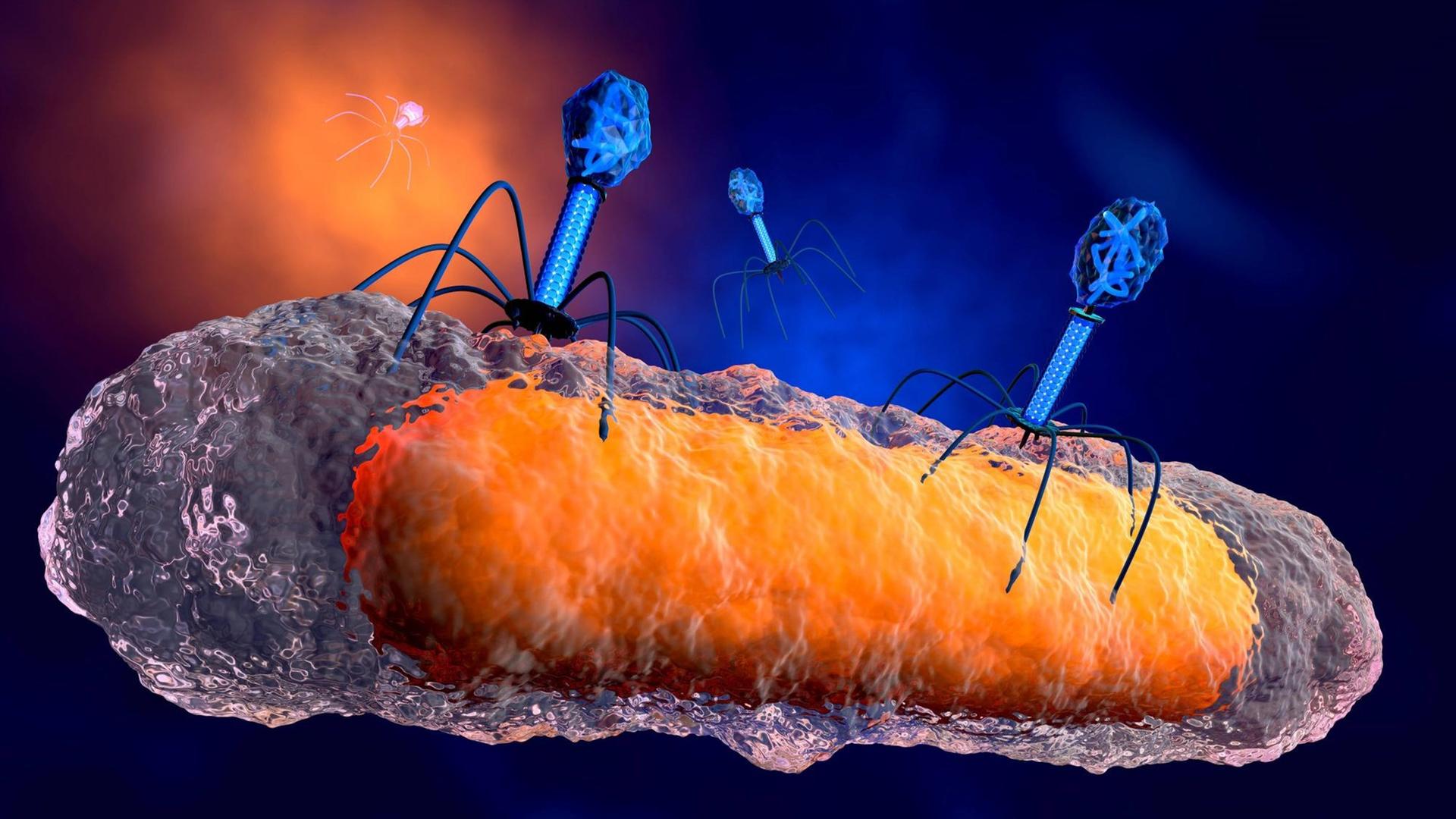
Brüssel, im Frühjahr 2016: Im Erasmus-Hospital kämpft eine junge Frau nach einem Bombenattentat ums Überleben. Sie übersteht unter anderem einen septischen Schock und eine massive Pilzinfektion. Nur der gebrochene Oberschenkelknochen, der von außen mit einem Metallgestell zusammengehalten wird, will einfach nicht heilen.
Schuld sind multiresistente Bakterien der Art Klebsiella pneumoniae. Damals mit zuständig war die Ärztin Anaïs Eskénazi. Sie arbeitet heute in einem Krankenhaus in Französisch-Guyana:
„Das Problem war, dass es keine wirksamen Antibiotika gab. Ich fing also an, zu recherchieren und in einem Buch über außergewöhnliche Diagnose- und Behandlungsmethoden stieß ich auf die Therapie mit Phagen.“
Phagen können Bakterien töten
Phagen sind Viren, die praktisch überall in der Umwelt vorkommen und Bakterien töten können. In Georgien, Polen oder Russland zum Beispiel werden bakterielle Infektionen schon seit fast 100 Jahren mit Phagen therapiert. Aber: „In der wissenschaftlichen Gemeinde des Westens stieß die Idee, Bakterien mit Viren zu behandeln, lange auf Skepsis. Wir mussten erstmal fundiertes Knowhow an die Klinik bringen, bevor wir es den anderen Ärzten im Team überhaupt vorschlagen konnten.“
Anaïs Eskénazi kontaktierte den belgischen Phagen-Experten Jean-Paul Pirnay am Königin-Astrid-Militärkrankenhaus. Er arbeitet schon seit vielen Jahren mit dem georgischen Eliava-Institut zusammen. Im Archiv des Instituts wurde schnell ein geeignetes Virus gegen den hartnäckigen Bakterienstamm in der Oberschenkelwunde gefunden. Ursprünglich stammte es aus einer lokalen Abwasserprobe.
Optimierte Viren aus dem Labor
Wie es dann weiterging? Um ihre Schlagkraft noch zu steigern, seien die ausgewählten Phagen im Labor immer wieder mit den Bakterien aus der Wunde zusammengebracht worden, erzählt Jean-Paul Pirnay:
"Man verdünnt die Mischung so lange, dass man gerade noch eine Phagenaktivität sieht und arbeitet dann mit diesen Viren weiter. Es ist wie eine natürliche Selektion, nur schneller."
Nach 15 Selektionsrunden war das Team zufrieden. Gen-Analysen zeigten zudem, dass der optimierte Phage keine Gene an Bord hatte, die zu weiteren Antibiotikaresistenzen führen könnten und auch keine Baupläne für Giftstoffe. Außerdem prüften die Forschenden, wie gut eine Kombination aus Phagen und Antibiotika wirkt.
Wunde komplett geheilt
„Die Gesamtaktivität war nicht nur additiv. Es gab tatsächlich einen Synergieeffekt. Wir konnten das in Flüssigkeiten und an einem Biofilm aus Bakterien zeigen. Wir haben den Bakteriumstamm aus den Patientenproben genommen und zunächst nur mit Antibiotika versetzt, dann nur mit Phagen und mit einer Kombination aus beiden. Und wir haben gesehen: Die Kombination wirkt sehr effektiv.“
Eine Kombination kam schließlich auch im Brüsseler Krankenhaus zum Einsatz, wenngleich erst nach fast zwei Jahren, als die reine Antibiotikatherapie offiziell als gescheitert galt. Schon wenige Tage nach der Phagengabe sei eine Besserung eingetreten, heißt es in der im Fachjournal "Nature Communications" veröffentlichten Studie. Nach drei Monaten war die Wunde komplett geheilt und der Oberschenkelknochen wieder zusammengewachsen. Unerwünschte Nebenwirkungen gab es offenbar nicht.
Kontrollierte Studien fehlen
Gleichwohl ist es nur eine Fallstudie. Ob diese Art der Phagentherapie auch für andere Patienten taugt, ob Antibiotika und Phagen besser gleichzeitig oder nacheinander verabreicht werden sollten, lässt sich nicht ableiten. Dazu seien groß angelegte, kontrollierte Studien nötig und für viele aktuelle Therapieanfragen auch die Unterstützung von Unternehmen, sagt Jean-Paul Pirnay.
Pirnay berichtet, dass sein Krankenhaus viele solcher Anfragen bekommt: "Im Schnitt jeden Tag eine. Aber wir sind kein Pharmaunternehmen, sondern Forscher an einer Klinik. Wir können nicht bis zu 400 Patienten im Jahr behandeln und müssen eine Triage machen. Ich denke, es ist an der Zeit, dass Unternehmen ins Spiel kommen und investieren.“