Der britisch-schwedische Konzern AstraZeneca hat Produktionsprobleme und kann die mit der EU vereinbarten Impfdosen nicht rechtzeitig liefern. Und: Nach Großbritannien wurde offenbar mehr Impfstoff geliefert als in die EU. Die EU-Kommission setzt den Konzern nun unter Druck und fordert unter anderem eine Offenlegung der Verträge. Ein Treffen am Mittwoch (27.01.2021) sollte die Differenzen zwischen dem Konzern und der EU-Kommission klären, doch das Treffen wurde erst vertagt, fand dann doch statt – zu einer Einigung kam es trotzdem nicht.
Die SPD-Politikerin Katarina Barley ist Vizepräsidentin des EU-Parlaments, das als Kontrollgremium der Kommission dient. Sie sieht die Bringschuld bei AstraZeneca. Das Problem sei bei AstraZeneca in deren Werk entstanden und müsse darum auch von AstraZeneca gelöst werden, so Barley im Dlf. Die EU-Kommission wiederum hat sich offenbar auf Vereinbarungen eingelassen, die besagen, dass Verträge nicht öffentlich einsehbar sind. Das hält Barley für einen großen Fehler.

Das ganze Interview im Wortlaut:
Jörg Münchenberg: Frau Barley, wie ist Ihr Eindruck? Versucht da derzeit der Pharmakonzern AstraZeneca, die EU über den Tisch zu ziehen?
Katarina Barley: Das ist sehr schwer zu beurteilen. Sie haben in dem Beitrag ja sehr richtig dargestellt, dass der Vertrag für die Öffentlichkeit nicht einsehbar ist. Er ist allerdings auch für die europäischen Parlamentarier und Parlamentarierinnen nicht einsehbar, und das ist wirklich ein Problem. Das ist ein Problem, aus dem wir auch lernen sollten für die Zukunft. Wir können nur Parallelen ziehen zu dem einzigen Vertrag, der bisher in Teilen öffentlich gemacht worden ist – mit geschwärzten Passagen, auch das nur sehr begrenzte Transparenz. Das ist der Curevac-Vertrag. Da gibt es solche, sehr schwammigen Klauseln, best efforts, dass die Unternehmen das Möglichste tun müssen, um zu liefern. Aber wir bräuchten Einsicht in den kompletten Vertrag, um das wirklich beurteilen zu können.
"Das war offenbar Vertragsbestandteil"
Münchenberg: Die Frage ist, warum wird dieser Vertrag nicht veröffentlicht. Sie haben ja selber schon gesagt, auch die EU-Kommission war da ja sehr zurückhaltend.
Barley: Offensichtlich ist das eine Vereinbarung zwischen der EU und den entsprechenden Unternehmen gewesen. Das war offenbar Vertragsbestandteil, das nicht zu tun. Bei Curevac hat es offenbar eine andere Vereinbarung gegeben. Deswegen drängt die EU-Kommission ja auch so darauf, dass AstraZeneca jetzt zustimmt, diesen Vertrag öffentlich zu machen. Die wollen das nicht. Warum – darüber können wir leider nur spekulieren.
"Die wichtigsten Passagen waren geschwärzt"
Münchenberg: Aber liegt der Fehler nicht auch ein Stück weit bei der EU-Kommission, die ja sich darauf eingelassen hatte, zum Beispiel mit AstraZeneca den Vertrag nicht zu veröffentlichen? Man hätte ja von vornherein auch sagen können, wir gehen auf Transparenz bei so einem wichtigen Thema wie Herstellung von Impfstoffen, Beschaffung von Impfstoffen, wir wollen das auch öffentlich machen?
Barley: Absolut! Ich will das auch durchaus als Kritik an der Kommission verstanden wissen. Gerade das Parlament – ich meine, wir sind ein Organ zur Kontrolle der Kommission, und wir hatten beim Curevac-Vertrag zunächst nur die Möglichkeit, für eine begrenzte Zeit in einem geschlossenen Raum diesen Vertrag einzusehen. Die Handys mussten abgegeben werden. Man durfte keine Notizen machen und die wichtigsten Passagen waren geschwärzt. Das, was man gelesen hatte, darüber durfte man mit niemandem reden. Das ist keine Form von Transparenz und so kann selbst ich als wirklich glühende Europäerin die Kommission dann auch nicht in Schutz nehmen.
"Es geht im Moment um Impfdosen"
Münchenberg: Sie haben es schon gesagt und das ist allgemein bekannt. Es steht Aussage gegen Aussage. Wenn die Kommission aber sagt, dass sie eigentlich im Recht sei, dann könnte sie zum Beispiel auch auf Entschädigung klagen. Man ist ja auch finanziell in Vorleistung gegangen, hat über 300 Millionen für Entwicklung und Forschung vorgestreckt. Eigentlich müsste man doch sagen, so wie Brüssel argumentiert, ist die Kommission doch eigentlich in einer ganz guten Position.
Barley: Ja. Nur es geht im Moment nicht um Geld. Es geht im Moment um Impfdosen. Wir brauchen Impfungen. Darauf wartet die Bevölkerung und darauf wartet sie zurecht. Es ist der europäischen Bevölkerung in Aussicht gestellt worden, sowohl von der EU als auch von der Kommission als auch von den nationalen Regierungen, dass das jetzt bald losgeht. Vom deutschen Gesundheitsminister wurde auch schon ein Zeitraum genannt, bis wann die Impfungen abgeschlossen werden sollen. Wenn wir irgendwann Entschädigungen bekommen, das hilft uns ja nicht, sondern wir wollen Impfdosen.
Der Punkt für mich ist: Diese ganzen rechtlichen Streitigkeiten, die können gerne irgendwann aussortiert werden. Ich bin der Meinung, dass man jetzt dafür sorgen muss, dass mehr produziert wird, und da ist auch AstraZeneca in der Pflicht, gegebenenfalls mit anderen Pharmaunternehmen zusammenzuarbeiten. Wir haben das jetzt kürzlich gesehen, dass BioNTech zum Beispiel Sanofi noch mit an Bord genommen hat, wo BioNTech-Impfstoff hergestellt wird. Dann muss man ein bisschen vom Kuchen abgeben, ein bisschen vom Gewinn mit jemandem teilen. Aber man kommt dann mit seiner Verpflichtung nach, schnell Impfstoff zu produzieren.
"Das Problem entsteht bei AstraZeneca"
Münchenberg: Auf der anderen Seite sagt AstraZeneca, sie seien ja bemüht, aber können im Augenblick nicht mehr produzieren, weil es Probleme gibt in einigen Werken in Europa.
Barley: Ja, es gibt wohl Probleme in einem Werk in Belgien. Aber wie gesagt, bisher sind meines Wissens nur Produktionsstätten von AstraZeneca selbst im Gespräch oder diejenigen Produktionsstätten, die von Anfang an im Blick waren. In einer solchen Notsituation – das Problem entsteht ja bei AstraZeneca in deren Werk. Das Problem entsteht ja nicht von Seiten der EU. Dann muss AstraZeneca dieses Problem lösen. Und es gibt ja noch viele weitere Pharmahersteller in Europa. Dann müssen sie einen sonst Konkurrenten suchen, der für sie produziert. Auch das wird Verzögerungen mit sich bringen, natürlich, aber diese Produktionsausfälle, die sind ja jetzt schon eine Weile bekannt. Die müssen sich dann schnell bemühen, woanders etwas herzubekommen. Das ist eigentlich ganz normal, ein ganz normaler Weg, Verträge zu erfüllen.
Notfallzulassung in Großbritannien, Marktzulassung in der EU
Münchenberg: Trotzdem steht am Ende der Vorwurf im Raum, dass die Kommission schlecht verhandelt habe. Die Briten frohlocken ja schon und sagen, sie hätten es viel besser gemacht als die Europäer.
Barley: Der Punkt, auf den sich AstraZeneca stützt, ist ja, dass die Briten vorher bestellt haben. Das hat was damit zu tun, dass die Briten nur eine Notfallzulassung ausgesprochen haben, während in der EU eine Marktzulassung erteilt wurde. Da sage ich Ihnen jetzt auch: Wenn ich mit Menschen spreche, höre ich ganz oft auch von Leuten, die jetzt keine Impfleugner sind oder fundamentalen Impfgegner sind, dass die ein bisschen Bauchschmerzen haben, dass die es schon jetzt sehr schnell finden, wie diese Zulassung gegangen ist, was ja auch stimmt. Im Vergleich zu der Zulassungsdauer im normalen Verfahren war das jetzt sehr schnell, weil alle Kräfte konzentriert wurden. Die Notfallzulassung ist tatsächlich nicht das gleiche wie eine Marktzulassung und ich finde es durchaus nachvollziehbar, dass man in der EU eine Marktzulassung vorgenommen hat und nicht eine Notfallzulassung.
Bedingte Marktzulassung und Notfallzulassung - die wichtigsten Unterschiede
Notfallzulassung: Sie wird nur vorübergehend - für die Zeit des Notfalls - erteilt. Das Medikament muss noch nicht zugelassen sein und die Qualitätsprüfung – z.B. auf welchem Stand Studien und Tests zu Sicherheit und Wirksamkeit des Medikaments sind – liegt im Ermessen des Staates. Im Fall einer Notfallzulassung haftet nicht das Unternehmen, sondern der Staat, der die Notfallverordnung erlassen hat.
Bedingte Marktzulassung: Sie gilt zunächst für ein Jahr. Die Prüfung des Medikaments unterliegt den Richtlinien der Europäischen Arzneimittel-Agentur (EMA). Es müssen noch nicht alle Studien, etwa zu Langzeitwirkungen, vorhanden sein. Die Unternehmen verpflichten sich jedoch, die fehlenden Studien zu einem bestimmten Zeitpunkt nachzureichen und ihre Forschung fortzusetzen. Die Haftung übernimmt im Fall einer bedingten Marktzulassung in der Regel das Unternehmen und nicht der Staat. Allerdings gibt es bei den Verträgen mit den Impfstoffherstellern Entschädigungsklauseln, die die Hersteller im Fall einer Klage auf Schadenersatz entlasten sollen. In einer Pressemitteilung der EU-Kommission zur Unterzeichnung der Verträge mit AstraZeneca heißt es: "Die Vorverträge mit den Unternehmen sehen aber Entschädigungsklauseln vor für den Fall, dass ein Hersteller zu Schadenersatzzahlungen verurteilt würde."
(Weitere Quelle: Fragen und Antworten zum BioNTech-Zulassungsverfahren)
Notfallzulassung: Sie wird nur vorübergehend - für die Zeit des Notfalls - erteilt. Das Medikament muss noch nicht zugelassen sein und die Qualitätsprüfung – z.B. auf welchem Stand Studien und Tests zu Sicherheit und Wirksamkeit des Medikaments sind – liegt im Ermessen des Staates. Im Fall einer Notfallzulassung haftet nicht das Unternehmen, sondern der Staat, der die Notfallverordnung erlassen hat.
Bedingte Marktzulassung: Sie gilt zunächst für ein Jahr. Die Prüfung des Medikaments unterliegt den Richtlinien der Europäischen Arzneimittel-Agentur (EMA). Es müssen noch nicht alle Studien, etwa zu Langzeitwirkungen, vorhanden sein. Die Unternehmen verpflichten sich jedoch, die fehlenden Studien zu einem bestimmten Zeitpunkt nachzureichen und ihre Forschung fortzusetzen. Die Haftung übernimmt im Fall einer bedingten Marktzulassung in der Regel das Unternehmen und nicht der Staat. Allerdings gibt es bei den Verträgen mit den Impfstoffherstellern Entschädigungsklauseln, die die Hersteller im Fall einer Klage auf Schadenersatz entlasten sollen. In einer Pressemitteilung der EU-Kommission zur Unterzeichnung der Verträge mit AstraZeneca heißt es: "Die Vorverträge mit den Unternehmen sehen aber Entschädigungsklauseln vor für den Fall, dass ein Hersteller zu Schadenersatzzahlungen verurteilt würde."
(Weitere Quelle: Fragen und Antworten zum BioNTech-Zulassungsverfahren)
"Die EU hat zwei Milliarden Impfdosen bestellt"
Münchenberg: Auf der anderen Seite ist von einer Jahrhundert-Pandemie die Rede. Man hat zum Beispiel in Deutschland die ganzen Strukturen für Impfstraßen aufgebaut. Die Infrastruktur ist vorhanden, nur nicht ausreichend Impfstoff. Insofern muss die Kritik doch da ansetzen, dass man sagt, wir haben da vielleicht auch zu wenig eingekauft, weil wir auch das Risiko nicht eingehen wollten, hier vielleicht viel Geld für einen Impfstoff auszugeben, der am Ende gar nicht wirkt.
Barley: Die EU hat zwei Milliarden Impfdosen bestellt bei insgesamt, ich glaube, sechs oder sieben Herstellern, sehr weit gestreut. Das war auch vom Ansatz her ja vernünftig, weil niemand wusste, wann wird der erste Impfstoff marktreif, wann ist er ausgereift. Die größte Menge, 600 Millionen Dosen sind bei BioNTech-Pfizer geordert worden. Zwei Milliarden Dosen insgesamt. Wenn Sie jetzt rechnen, wir haben 450 Millionen Einwohner in der EU – manche dieser Impfprodukte müssen zweimal verabreicht werden, aber auch nicht alle. Selbst wenn alle zweimal verimpft werden müssten, hätten wir noch mehr als doppelt so viel, wie wir brauchen. Dass die EU zu wenig eingekauft hätte, das kann man wirklich nicht sagen.
Der Punkt ist hier wirklich, dass AstraZeneca nicht das liefert, was es offenbar liefern sollte, und das muss jetzt dringend behoben werden. "Was wir nicht brauchen, sind Schuldzuweisungen"
Münchenberg: Frau Barley, Ihre Prognose zum Schluss. Wie wird das ausgehen? Es gab ja gestern Abend noch mal dieses Treffen. Da hat man sich auch nicht geeinigt. Die Kommission ist mittlerweile bereit, die Verträge offenzulegen. Wie wird das Ganze ausgehen?
Barley: Ich hoffe, dass auch unter dem Druck möglicher Strafzahlungen am Ende tatsächlich AstraZeneca sich bemühen wird, andere Produktionskapazitäten zu finden. Diesen Lösungsweg habe ich ja eben aufgezeigt. Ich denke, das ist der einzige, der am Ende allen hilft. Denn was wir nicht brauchen, sind Schuldzuweisungen. Wir brauchen, dass sich alle an einen Tisch setzen und konstruktive Lösungen suchen, national wie europäisch.
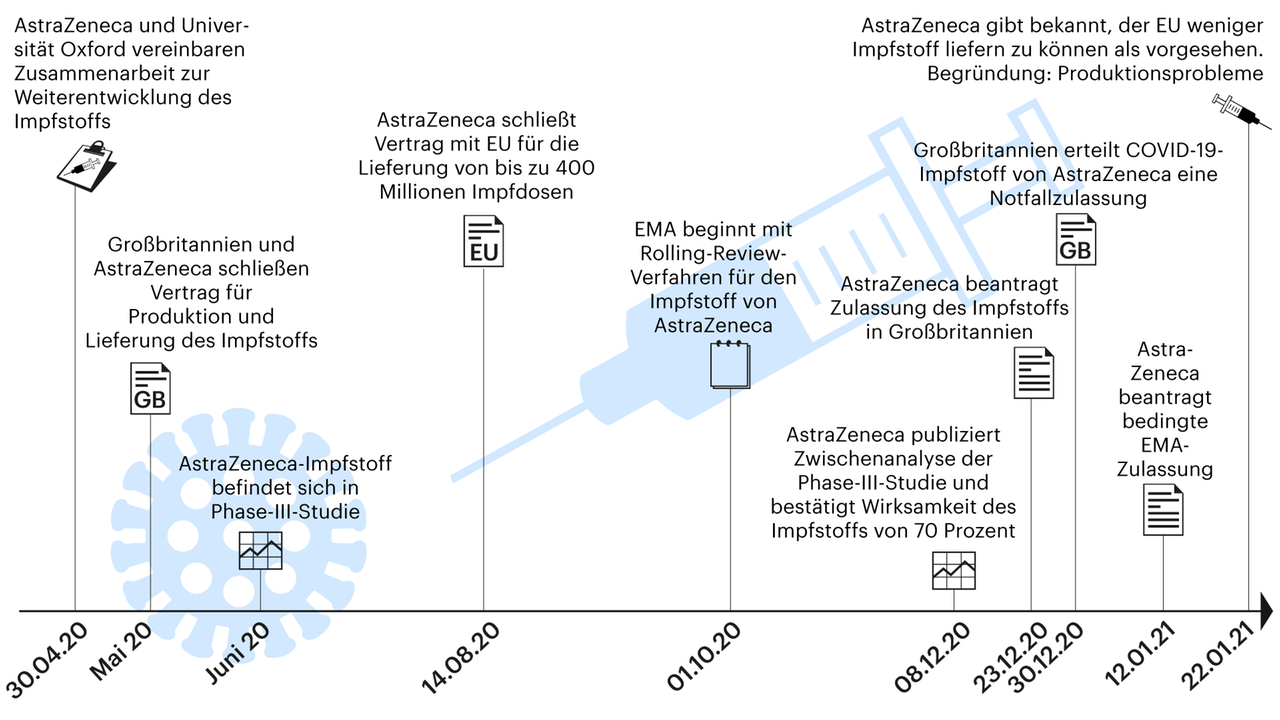
- Mai 2020: Großbritannien und AstraZeneca schließen Vertrag für Produktion und Lieferung des Impfstoffs
- Juni 2020: AstraZeneca-Impfstoff befindet sich in Phase-III-Studie
- 14. August 2020: AstraZeneca schließt Vertrag mit EU für die Lieferung von bis zu 400 Millionen Impfdosen
- 08. Dezember 2020: AstraZeneca publiziert Zwischenanalyse einer Phase-III-Studie und bestätigt Wirksamkeit des Impfstoffs von 70 Prozent (in The Lancet veröffentlicht)
- 23. Dezember 2020: AstraZeneca beantragt Zulassung des Impfstoffs in Großbritannien
- 30. Dezember 2020: Großbritannien erteilt COVID-19-Impfstoff von AstraZeneca eine Notfallzulassung
- 12. Januar 2021: AstraZeneca beantragt bedingte EMA-Zulassung
- 22. Januar 2021: AstraZeneca gibt bekannt, der EU weniger Impfstoff liefern zu können als vorgesehen. Begründung: Produktionsprobleme
Äußerungen unserer Gesprächspartner geben deren eigene Auffassungen wieder. Der Deutschlandfunk macht sich Äußerungen seiner Gesprächspartner in Interviews und Diskussionen nicht zu eigen.