Alzheimerpatienten und ihre Angehörigen warten verzweifelt auf neue Medikamente, mussten immer wieder mit ansehen, wie vielversprechende Studien im Sand verliefen. Kein Wunder, dass Sabine Jansen, Geschäftsführerin der Deutschen Alzheimer Gesellschaft, die Entscheidung in den USA zu Aducanumab genau verfolgt hat. "Einerseits ist das natürlich ein Hoffnungsschimmer. Wir haben ja eine lange Zeit, wo überhaupt kein neues Alzheimer Medikament zugelassen worden ist."
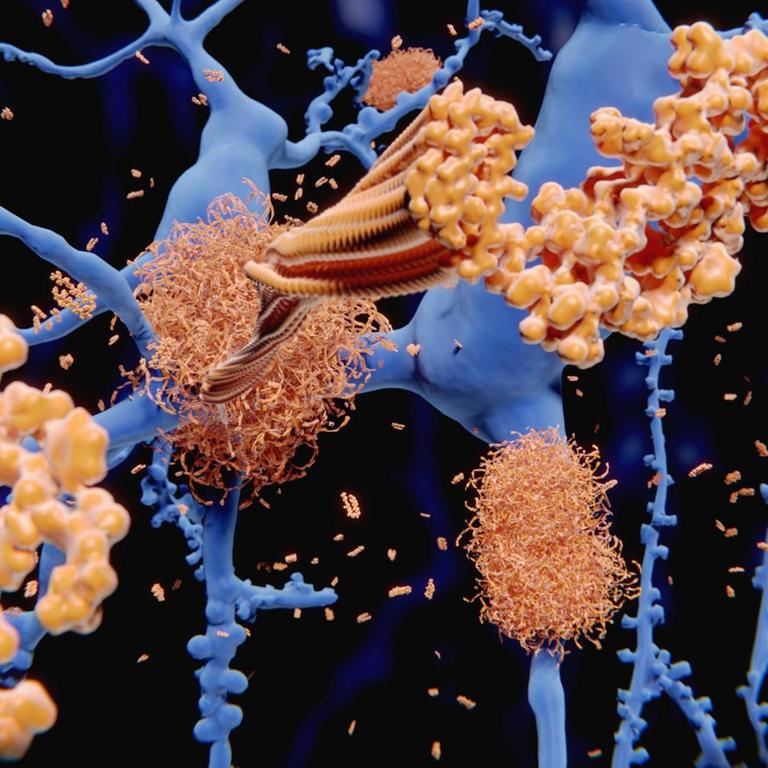
Noch dazu greift Aducanumab erstmals an der Wurzel in den Krankheitsprozess ein. Er lindert also nicht die Symptome, wie bisher verfügbare Medikamente, sondern soll die Amyloid-Plaques abbauen, eine der beiden Ablagerungsformen im Gehirn der Alzheimerpatienten. Ob das den Gedächtnisverlust wirklich effektiver verzögert, ist unklar. Die FDA hat zwar eine Zulassung erteilt, den Hersteller Biogen aber verpflichtet, die Wirksamkeit in einer weiteren Studie eindeutig nachzuweisen. "Das verunsichert auf jeden Fall die Patienten und wir sind jetzt sehr gespannt, wie die europäische Zulassungsbehörde entscheidet, die für uns in Deutschland ja relevant ist", sagt Jansen.
Unklare Datenlage
Wie die EMA Ende des Jahres entscheiden wird, gilt als völlig offen, denn die Datenlage ist gelinde gesagt unübersichtlich. Es gab zwei große Studien zu Aducanumab. Eine Zwischenauswertung sah keinen Hinweis auf eine Wirkung, deshalb wurde abgebrochen. In der Zwischenzeit waren aber weiter Daten aufgelaufen, in denen Biogen zumindest in der einen Studie, bei einigen Tests eine Verlangsamung des Gedächtnisverlustes erkennen wollte.
"Das größte Problem finde ich, dass man jetzt Rosinenpickerei betreibt", sagt Jörg Schaaber, der schon lange Studiendaten bei der kritische Buko Pharma-Kampagne analysiert. Normalerweise wird vor einer Studie festgelegt, wie die Daten ausgewertet werden. Aufgrund dieser Kriterien wurden die Studien abgebrochen. "Wenn man dann irgendwelche geringfügigen Ergebnisse, die man auch nebenbei mit gemessen hat, aber die nicht zu den primären Zielen gehören, dann plötzlich als das Wichtigste erklärt, dann ist das einfach fishy."
Druck von Herstellern, Politik und Patienten
Tatsächlich hatte ein Expertengremium der FDA von der Zulassung abgeraten. Aber die Arzneimittelbehörde steht unter einem hohen Druck, er kommt von den Herstellern, von der Politik, vor allem auch von den Patienten, die seit Jahrzehnten auf Alzheimermedikamente warten. Die Zulassung rechtfertigt die FDA jetzt vor allem damit, dass Aducanumab tatsächlich Amyloid abbaut, also im Grunde mit einem Laborparameter.
"Ich persönlich finde die Entscheidung, weil ich die Daten auch recht gut kenne, nachvollziehbar. Und trotzdem ist in gewisser Weise eine Tür aufgemacht worden, wo man schauen muss, dass die nicht zu weit aufgeht und dass man später denkt, jede Substanz, die irgendwas an irgendeinem Biomarker macht, kann ich zulassen. Das wäre dann auch nicht mehr im Interesse der Patienten", sagt der Neurologe Frank Jessen, der an der Uniklinik Köln selbst Patienten mit Aducanumab behandelt hat. "Bei einzelnen Patienten haben wir an diesen Studien teilgenommen, dass man teilweise schon doch lange Stabilisierungsphasen erreichen kann, zum Beispiel über den Zeitraum dieser Studien von 18 Monaten, wahrscheinlich insbesondere bei den Patienten mit den hohen Dosierungen."
Neue Studie soll Klarheit bringen
Es wird darauf ankommen, vorab geeignete Patienten zu identifizieren. In den Studien ging es um Menschen ganz am Anfang der Demenz, zugelassen hat die FDA Aducanumab aber für alle Alzheimerpatienten. "Das finde ich einen kritischen Punkt, eigentlich fast den kritischsten Punkt an der ganzen Thematik. Weil wenn man jetzt zum Beispiel einen Patienten mit einer fortgeschrittenen Alzheimer Demenz behandeln würde, dann würde man diesen Patienten einer Situation aussetzen, die es in der Studie nie gegeben hat", sagt Frank Jessen. Er ist sich sicher, dass die Europäische Arzneimittelagentur auf keinen Fall eine so breite Zulassung aussprechen wird. Auf längere Sicht wird die von der FDA vorgeschriebene wissenschaftlich exakte Studie Klarheit bringen.
Bis es so weit ist, kommen aber auf die amerikanischen Krankenversicherer hohe Kosten zu. Ein Jahr Aducanumab schlägt mit 56.000 Dollar zu Buche, dazu kommen Hirnscans zur Überwachung möglicher Nebenwirkungen. "Das heißt, die gesetzliche Krankenversicherung bezahlt dann im Grunde genommen einen Arzneimittelversuch, den eigentlich der Hersteller bezahlen müsste", so Jörg Schaaber.
Alzheimerforschung wird wieder interessant
Die Alzheimerpatienten und ihre Angehörigen müssen weiter auf Therapien hoffen, die den Gedächtnisverlust nicht nur verlangsamen, sondern stoppen. Entscheidend wird wohl die Kombination verschiedener Ansätze sein. Insofern begrüßt Sabine Jansen die Entscheidung der FDA, denn sie macht das Thema Alzheimer wieder interessanter für Pharmafirmen und Wissenschaft.
"Ich denke, es gibt vielleicht schon einen Schub, weiter zu forschen, dass es mal wieder überhaupt irgendwie Ansätze für Erfolge gibt. Wir haben eine große Zahl von Menschen, die eigentlich dringend auf Behandlung warten und von daher kann man nur hoffen, dass das irgendwie die Forschenden motiviert, weiter dran zu arbeiten, auch unterschiedliche Ansätze zu verfolgen."