"Das ist unser spezieller Raum, an dem hängt auch die Lizenz, die wir bekommen haben. Man braucht eine besondere Erlaubnis, um hier rein zu kommen."
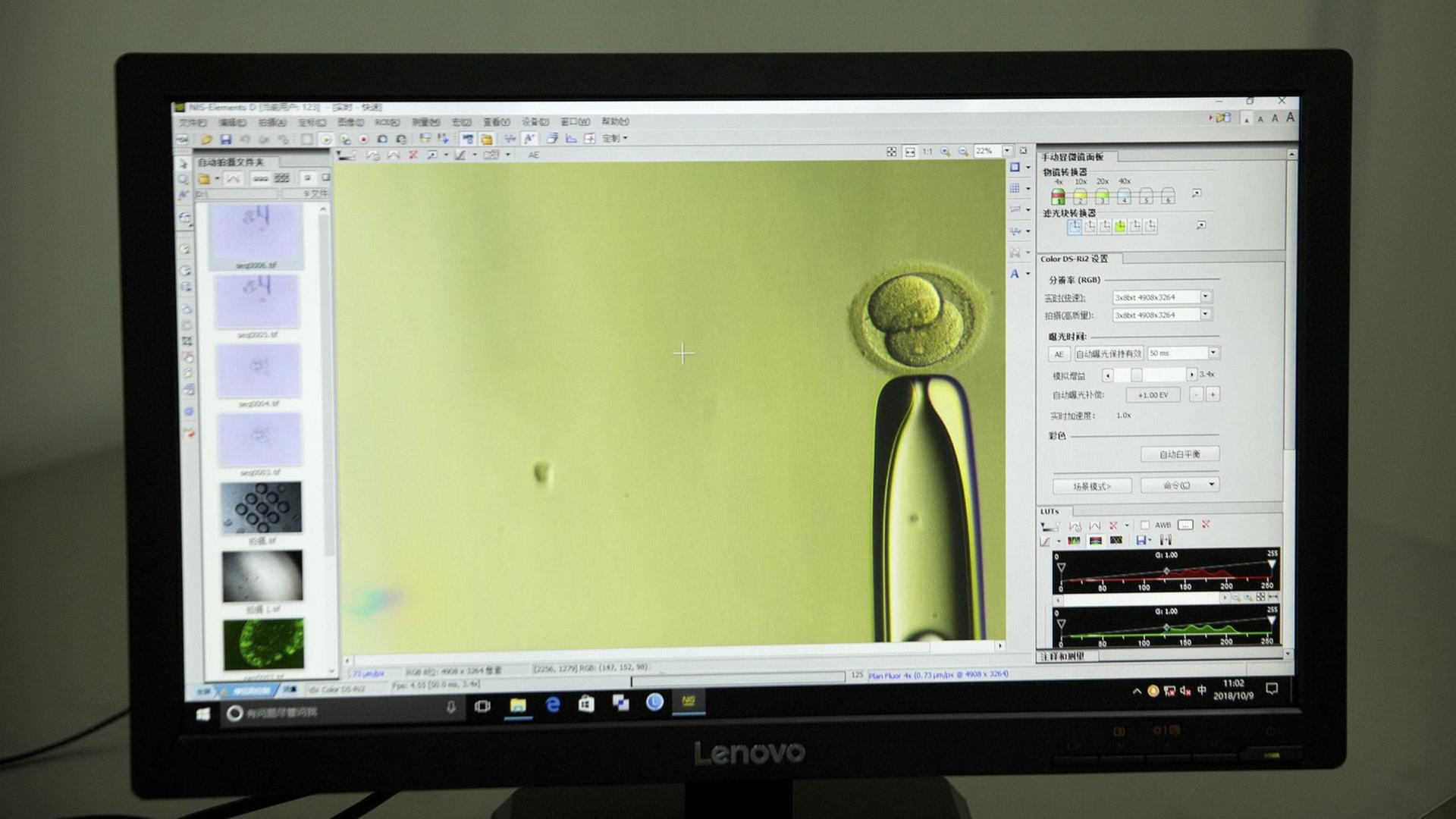
Sophie Brumm öffnet die Tür mit einer Schlüsselkarte. Ein fensterlosen Raum, zwei Sterilbänke für Arbeiten mit Zellen, kühlschrank-große Inkubatoren und verschiedene Mikroskope. Die Doktorandin zeigt auf einen niedrigen grauen Stickstofftank in einer Ecke, der blaue Deckel ist mit einem Vorhängeschloss gesichert.
"Hier bewahren wir die menschlichen Embryonen auf, die wir als Spende von Kinderwunsch-Kliniken bekommen haben. Sie werden in Plastikstrohhalmen gelagert und in flüssigem Stickstoff eingefroren. Und direkt daneben können wir sie wieder auftauen."
Die Embryonen sind nur wenige Tage alt, wenn sie eingefroren werden. Winzige Zellklumpen, die mit dem bloßen Auge gerade so zu erkennen sind, erzählt Sophie Brumm. Nach dem Auftauen dürfen sie im Labor nur so lange kultiviert und untersucht werden, bis sie ein Alter von 14 Tagen erreicht haben. Dann wird ihre Entwicklung gestoppt. An den Moment, als sie zum ersten Mal mit einem humanen Embryo gearbeitet hat, kann sich Sophie Brumm noch gut erinnern.
"Es ist einschüchternd- weil das Material, mit dem man arbeitet so unglaublich kostbar ist und wir so wenige Embryonen zur Verfügung haben. Jedes einzelne zählt und deshalb muss man sich jedes Experiment, das man plant, wirklich gründlich überlegen, um das Maximum an Informationen herauszuholen. Es ist nicht wie mit Mäuseembryonen, wo man hunderte gleichzeitig verwenden kann. Es ist wirklich immer nur ein bis zwei. Und wenn man die von einer Petrischale in eine andere überführt, muss man wirklich sicher sein. Das verursacht richtiges Herzklopfen."
"Hier bewahren wir die menschlichen Embryonen auf, die wir als Spende von Kinderwunsch-Kliniken bekommen haben. Sie werden in Plastikstrohhalmen gelagert und in flüssigem Stickstoff eingefroren. Und direkt daneben können wir sie wieder auftauen."
Die Embryonen sind nur wenige Tage alt, wenn sie eingefroren werden. Winzige Zellklumpen, die mit dem bloßen Auge gerade so zu erkennen sind, erzählt Sophie Brumm. Nach dem Auftauen dürfen sie im Labor nur so lange kultiviert und untersucht werden, bis sie ein Alter von 14 Tagen erreicht haben. Dann wird ihre Entwicklung gestoppt. An den Moment, als sie zum ersten Mal mit einem humanen Embryo gearbeitet hat, kann sich Sophie Brumm noch gut erinnern.
"Es ist einschüchternd- weil das Material, mit dem man arbeitet so unglaublich kostbar ist und wir so wenige Embryonen zur Verfügung haben. Jedes einzelne zählt und deshalb muss man sich jedes Experiment, das man plant, wirklich gründlich überlegen, um das Maximum an Informationen herauszuholen. Es ist nicht wie mit Mäuseembryonen, wo man hunderte gleichzeitig verwenden kann. Es ist wirklich immer nur ein bis zwei. Und wenn man die von einer Petrischale in eine andere überführt, muss man wirklich sicher sein. Das verursacht richtiges Herzklopfen."
Eingriffe in die menschlichen Embryonalentwicklung
Für ihre Forschung verwendet Kathy Niakans Arbeitsgruppe ausschließlich Embryonen, aus Kinderwunschbehandlungen, die sonst entsorgt werden würden. Die Entscheidung über eine Spende treffen die jeweiligen Paare. Vielen Paaren wollten auf diese Weise dazu beitragen, dass es mehr Wissen über die frühe Embryonalentwicklung gibt und dadurch vielleicht irgendwann weniger Fehlgeburten, erzählt Kathy Niakan.
"Unsere Forschung konzentriert sich auf die ersten sieben Tage der menschlichen Entwicklung, also ab dem Zeitpunkt, an dem eine Eizelle von einem Spermium befruchtet worden ist. Am ersten Tag ist der Embryo eine Zelle mit zwei Vorkernen. Am zweiten Tag teilt die sich dann in zwei Zellen und dann in vier Zellen, acht Zellen und so weiter. Bis ein Ball aus etwa zweihundert Zellen entstanden ist, die sogenannte Blastozyste. Von diesen zweihundert Zellen haben nur sieben bis zehn Zellen die Fähigkeit, den späteren Fötus zu bilden. Und wir untersuchen die molekularen Eigenschaften dieser Zellen."
Dazu schalten die Wissenschaftlerinnen gezielt einzelne Gene in den embryonalen Zellen aus. Das Protein, dessen Bauanleitung das jeweilige Gen enthält, wird dann nicht mehr gebildet und seine Funktion sichtbar. Natürlich kann man diese Experimente auch mit Embryonen von Mäusen oder anderen möglichst nah verwandten Tieren durchführen, erklärt Kathy Niakan. Sie und viele andere tun das seit Jahrzehnten. Aber mit Blick auf den Menschen bringe das nicht selten irreführende Ergebnisse.
"Wir wissen mittlerweile, dass es zwischen der Maus und dem Menschen wichtige Unterschiede gibt. Wir haben uns zum Beispiel die Funktion eines Proteins angesehen, das Oct4 heißt. Dieses Protein wird seit Jahrzehnten in der Maus erforscht. Wir wissen, dass sich bei Mäusen die Plazenta fehlerhaft entwickelt, wenn wir Oct4 ausschalten."
In den Mäuse-Embryos unterdrückt das Protein ein Programm, das die Bildung der Plazenta steuert. Fehlt das Protein, ist diese Programm dauerhaft aktiviert- auch in Zellen, die eigentlich keine Plazenta-Zellen werden sollten.
"Unsere Forschung konzentriert sich auf die ersten sieben Tage der menschlichen Entwicklung, also ab dem Zeitpunkt, an dem eine Eizelle von einem Spermium befruchtet worden ist. Am ersten Tag ist der Embryo eine Zelle mit zwei Vorkernen. Am zweiten Tag teilt die sich dann in zwei Zellen und dann in vier Zellen, acht Zellen und so weiter. Bis ein Ball aus etwa zweihundert Zellen entstanden ist, die sogenannte Blastozyste. Von diesen zweihundert Zellen haben nur sieben bis zehn Zellen die Fähigkeit, den späteren Fötus zu bilden. Und wir untersuchen die molekularen Eigenschaften dieser Zellen."
Dazu schalten die Wissenschaftlerinnen gezielt einzelne Gene in den embryonalen Zellen aus. Das Protein, dessen Bauanleitung das jeweilige Gen enthält, wird dann nicht mehr gebildet und seine Funktion sichtbar. Natürlich kann man diese Experimente auch mit Embryonen von Mäusen oder anderen möglichst nah verwandten Tieren durchführen, erklärt Kathy Niakan. Sie und viele andere tun das seit Jahrzehnten. Aber mit Blick auf den Menschen bringe das nicht selten irreführende Ergebnisse.
"Wir wissen mittlerweile, dass es zwischen der Maus und dem Menschen wichtige Unterschiede gibt. Wir haben uns zum Beispiel die Funktion eines Proteins angesehen, das Oct4 heißt. Dieses Protein wird seit Jahrzehnten in der Maus erforscht. Wir wissen, dass sich bei Mäusen die Plazenta fehlerhaft entwickelt, wenn wir Oct4 ausschalten."
In den Mäuse-Embryos unterdrückt das Protein ein Programm, das die Bildung der Plazenta steuert. Fehlt das Protein, ist diese Programm dauerhaft aktiviert- auch in Zellen, die eigentlich keine Plazenta-Zellen werden sollten.
Zwischen Mensch und Maus gibt es wichtige Unterschiede
"Im Menschen sehen wir den komplett entgegengesetzten Effekt. Wenn wir Oct4 ausschalten, wird die Entwicklung der Plazenta gar nicht mehr in Gang gesetzt. Das zeigt uns etwas ganz wesentlich Neues. Und dass, obwohl dieses Protein schon seit Jahrzehnten untersucht worden ist. Es erfüllt in Maus und Mensch diametral entgegengesetzte Aufgaben. Das konnten wir im Mausmodelle nicht erkennen."
Bei diesen Versuchen haben Kathy Niakan und ihr Team auch mit CRISPR/Cas9 gearbeitet, um das Oct4-Gen auszuschalten. Jenem Werkzeug, das He Jiankui benutzt hat, um die ersten keimbahnveränderten Menschen zu erzeugen. Kathy Niakan darf die Technik seit vier Jahren auch an humanen Embryonen anwenden.
"CRISPR/Cas9 ist ein molekulares Werkzeug und derzeit die effizienteste und präziseste Methode, die es auf diesem Gebiet gibt. Wir können damit ein bestimmtes Gen im menschlichen Genom in den Blick nehmen und fragen: Ist dieses Gen wichtig für die Entwicklung oder nicht?"
Denn selbst wenn ein Gen zu einem bestimmten Zeitpunkt in den Zellen angeschaltet und das entsprechende Protein vorhanden ist, heißt das noch nicht, dass es tatsächlich eine wichtige Funktion hat. Das lässt sich nur herausfinden, indem man Proteine hemmt oder Gene ausschaltet. Für solche Experimente gibt es verschiedene Methoden. Doch CRISPR/Cas ist die mächtigste.
"Das Problem ist, dass Wachstumsfaktoren oder hemmenden Substanzen manchmal unspezifisch wirken und wenn es mit CRISPR/Cas eine präzisere Möglichkeit gibt, um herauszufinden, ob ein Gen und das jeweilige Protein wichtig sind, kann man so die Zahl der Embryonen reduzieren, die man in der Forschung braucht, um ans Ziel zu kommen."
Die Ergebnisse ihrer Arbeit scheinen die britische Regulierungsbehörde überzeugt zu haben. Kathy Niakans Lizenz für den Einsatz von CRISPR/Cas ist im Herbst 2019 um drei Jahre verlängert worden.
Bei diesen Versuchen haben Kathy Niakan und ihr Team auch mit CRISPR/Cas9 gearbeitet, um das Oct4-Gen auszuschalten. Jenem Werkzeug, das He Jiankui benutzt hat, um die ersten keimbahnveränderten Menschen zu erzeugen. Kathy Niakan darf die Technik seit vier Jahren auch an humanen Embryonen anwenden.
"CRISPR/Cas9 ist ein molekulares Werkzeug und derzeit die effizienteste und präziseste Methode, die es auf diesem Gebiet gibt. Wir können damit ein bestimmtes Gen im menschlichen Genom in den Blick nehmen und fragen: Ist dieses Gen wichtig für die Entwicklung oder nicht?"
Denn selbst wenn ein Gen zu einem bestimmten Zeitpunkt in den Zellen angeschaltet und das entsprechende Protein vorhanden ist, heißt das noch nicht, dass es tatsächlich eine wichtige Funktion hat. Das lässt sich nur herausfinden, indem man Proteine hemmt oder Gene ausschaltet. Für solche Experimente gibt es verschiedene Methoden. Doch CRISPR/Cas ist die mächtigste.
"Das Problem ist, dass Wachstumsfaktoren oder hemmenden Substanzen manchmal unspezifisch wirken und wenn es mit CRISPR/Cas eine präzisere Möglichkeit gibt, um herauszufinden, ob ein Gen und das jeweilige Protein wichtig sind, kann man so die Zahl der Embryonen reduzieren, die man in der Forschung braucht, um ans Ziel zu kommen."
Die Ergebnisse ihrer Arbeit scheinen die britische Regulierungsbehörde überzeugt zu haben. Kathy Niakans Lizenz für den Einsatz von CRISPR/Cas ist im Herbst 2019 um drei Jahre verlängert worden.