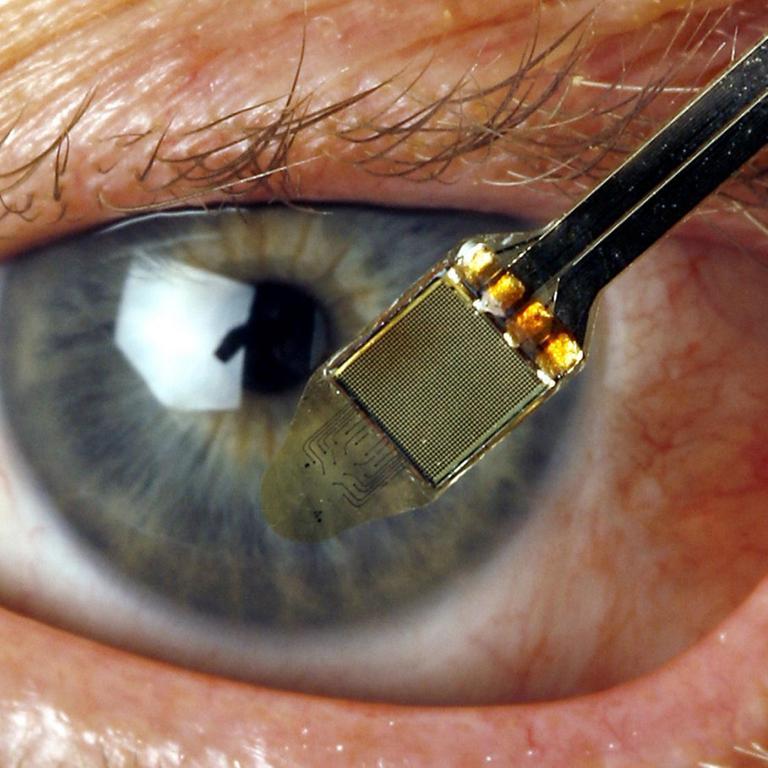
An das Innere eines Auges kommen Wissenschaftler nicht so leicht heran. Nur zu gerne würden sie an einer funktionierenden, lebenden Retina forschen. Deshalb nutzt Botond Roska vom Institut für Molekulare und Klinische Ophthalmologie in Basel eine Methode, um eine menschliche Netzhaut im Labor wachsen zu lassen.
"Wir züchten kleine Organoide mit verschiedenen Zelltypen. Der Aufbau dieser Mini-Organe entspricht der menschlichen Netzhaut, der Retina. Wir entnehmen bei einem Patienten eine Gewebeprobe, und in 200 Tagen haben wir Tausende Miniatur-Kopien dieser charakteristischen menschlichen Netzhaut."
"Wir züchten kleine Organoide mit verschiedenen Zelltypen. Der Aufbau dieser Mini-Organe entspricht der menschlichen Netzhaut, der Retina. Wir entnehmen bei einem Patienten eine Gewebeprobe, und in 200 Tagen haben wir Tausende Miniatur-Kopien dieser charakteristischen menschlichen Netzhaut."
Die Zellen wachsen ohne genetische Tricks
Das Organoid ist zwar kleiner als eine natürliche Netzhaut im Auge, aber es beherbergt alle Zellen, die auch in der Netzhaut vorkommen. Um die Mini-Organe zu züchten, brauchen die Wissenschaftler nicht einmal Material aus dem Auge eines Patienten.
"Wir stellen so genannte pluripotente Stammzellen her. Dazu reicht die Blutprobe eines Patienten oder eine Hauptbiopsie. Das sind reife Zellen eines Patienten, die wir mit bekannten biologischen Faktoren umprogrammieren, so dass sie zu Stammzellen werden. Danach brauchen wir keine genetischen Tricks mehr. Wir wählen lediglich die richtigen Zellen aus und lenken die Entwicklung der Zellen mit speziellen Botenstoffen und Proteinen in eine bestimmte Richtung. Und dann wachsen sie."
Auf der diesjährigen internationalen Tagung der Stammzellenforscher zeigte Botond Roska, was die Zellen in der künstlichen Netzhaut alles können. Forscher erhalten so die Möglichkeit, neue Heilverfahren an lebenden, menschlichen Geweben zu testen, ohne Tier- oder Menschenversuche.
Auf der diesjährigen internationalen Tagung der Stammzellenforscher zeigte Botond Roska, was die Zellen in der künstlichen Netzhaut alles können. Forscher erhalten so die Möglichkeit, neue Heilverfahren an lebenden, menschlichen Geweben zu testen, ohne Tier- oder Menschenversuche.
Verfahren zur Heilung Erblindeter
Aber Botond Roska betreibt nicht nur Grundlagenforschung. Ein Verfahren zur Heilung erblindeter Menschen, das Botond Roska bereits vor über zehn Jahren entwickelt hat, ist inzwischen praxisreif.
"Bei erblindeten Patienten testen wir eine Gentherapie. Dabei spritzen wir speziell programmierte Genfähren direkt ins Auge. Die Genfähren erreichen die Retina und sorgen dafür, dass dort lichtempfindliche Kanäle gebildet werden. Die Kanäle lassen elektrische Ladungen passieren, und die Netzhaut im Auge funktioniert wieder."
Diese Technik wird auch als Optogenetik bezeichnet. Dabei schleusen Wissenschaftler genetische Bauanleitungen für kleine Kanäle aus Bakterien oder Algen in lebende Zellen ein. Diese Kanäle reagieren auf Licht, so dass sich die Zellen anschließend mit Licht an- und ausschalten lassen. Das Verfahren wird bereits zur Behandlung von Blinden eingesetzt und zurzeit in Paris, London und Pittsburgh erprobt. Ende des Jahres sollen die ersten Ergebnisse vorliegen.
"Bei erblindeten Patienten testen wir eine Gentherapie. Dabei spritzen wir speziell programmierte Genfähren direkt ins Auge. Die Genfähren erreichen die Retina und sorgen dafür, dass dort lichtempfindliche Kanäle gebildet werden. Die Kanäle lassen elektrische Ladungen passieren, und die Netzhaut im Auge funktioniert wieder."
Diese Technik wird auch als Optogenetik bezeichnet. Dabei schleusen Wissenschaftler genetische Bauanleitungen für kleine Kanäle aus Bakterien oder Algen in lebende Zellen ein. Diese Kanäle reagieren auf Licht, so dass sich die Zellen anschließend mit Licht an- und ausschalten lassen. Das Verfahren wird bereits zur Behandlung von Blinden eingesetzt und zurzeit in Paris, London und Pittsburgh erprobt. Ende des Jahres sollen die ersten Ergebnisse vorliegen.
Sehen mithilfe von infrarotem Licht
Für andere Patienten, die nicht vollständig erblindet sind, ist dieses Verfahren jedoch nicht geeignet. Um auch ihnen zu helfen, hat das Team um Botond Roska eine molekulare Maschine entwickelt, die zusätzliche Sehfähigkeit verleihen soll. Diese Technik ist noch ganz neu, und wird erst im Labor ausprobiert.
"Wir verwenden Nano-Bauteile: Winzige kleine Goldstäbchen. Sobald nahes Infrarotlicht darauf trifft, erwärmen sich die Stäbchen. Wir haben sie mit speziellen Antikörpern an Ionen-Kanäle gekoppelt, so wie sie in der Retina vorliegen. Diese winzigen Maschinen fangen das Infrarotlicht ein, die Stäbchen werden heiß, die Hitze öffnet die Kanäle, und es fließt elektrischer Strom."
Botond Roska will mit dieser molekularen Maschine zukünftig Patienten helfen, die noch sehen, die aber ihre natürliche Sehkraft nach und nach verlieren. Ihre restliche Sehkraft soll ergänzt werden durch das Sehen von infrarotem Licht. Eine innovative Idee, aber noch weit von der Anwendung entfernt.
"Wir verwenden Nano-Bauteile: Winzige kleine Goldstäbchen. Sobald nahes Infrarotlicht darauf trifft, erwärmen sich die Stäbchen. Wir haben sie mit speziellen Antikörpern an Ionen-Kanäle gekoppelt, so wie sie in der Retina vorliegen. Diese winzigen Maschinen fangen das Infrarotlicht ein, die Stäbchen werden heiß, die Hitze öffnet die Kanäle, und es fließt elektrischer Strom."
Botond Roska will mit dieser molekularen Maschine zukünftig Patienten helfen, die noch sehen, die aber ihre natürliche Sehkraft nach und nach verlieren. Ihre restliche Sehkraft soll ergänzt werden durch das Sehen von infrarotem Licht. Eine innovative Idee, aber noch weit von der Anwendung entfernt.