Es geht ein paar Stufen hinauf. Dann auf zwei mehrstöckige Gebäude zu. Das eine elegant und amöbenhaft geschwungen, das andere ein viereckiger Funktionsbau. So unterschiedlich die Gebäude sind, so eng sind sie wissenschaftlich miteinander verbunden. Forscher arbeiten hier an einem neuen Blick auf das, was der Mensch ist: Nicht nur Organismus, sondern Metaorganismus. Ohne unsere Viren, Pilze und Bakterien sind wir nichts.
Im eckigen, weiß gestrichenen Funktionsbau fährt der Fahrstuhl hoch ins Zoologische Institut der Universität Kiel, zu Thomas Bosch. Über der Glastür zu seiner Abteilung klebt sein Leitstern als bunter Schriftzug: „Metaorganismus“.
Thomas Bosch, weißes Haar, leichter Dreitagebart, bittet in ein weiträumiges Büro. Zahlreiche Fotografien springen ins Auge, auf denen er mit anderen Wissenschaftlern zu sehen ist. Bosch ist international gut vernetzt und man merkt, dass er eine Botschaft hat. Warum ist er so fest davon überzeugt, dass wir ganz neu über die Beziehung zwischen Organismen und Mikroben nachdenken müssen?
„Es gibt in der Natur keine keimfreien, keine bakterienfreien Organismen, aus einem guten Grunde. Die Bakterien waren evolutionsgeschichtlich weit vor uns da, die Erde war 3,5 Milliarden Jahre besiedelt mit einem komplizierten Biofilm aus Bakterien, aus Viren, aus Archaeen und auf diesem und in diesem Biofilm hat sich dann irgendwann ein multizelluläres einfaches Leben entwickelt, wir gehen davon aus, dass das etwa 560-600 Millionen Jahre vor unserer Zeit war, und deswegen ist es im Nachhinein ganz logisch, dass Lebewesen, Gewebe und Lebensprozesse offensichtlich in enger Abhängigkeit von Mikroben ablaufen.“
Vor fünfzehn Jahren war Thomas Bosch noch davon überzeugt, dass ein Organismus dort aufhört, wo seine Körpergrenzen verlaufen. Er forschte damals bereits fast dreißig Jahre lang an dem Süßwasserpolypen Hydra, der zur über 500 Millionen Jahre alten Gruppe der Nesseltiere gehört. Dann veränderte das winzige, schlauchförmige Wesen seinen Blick.
Im eckigen, weiß gestrichenen Funktionsbau fährt der Fahrstuhl hoch ins Zoologische Institut der Universität Kiel, zu Thomas Bosch. Über der Glastür zu seiner Abteilung klebt sein Leitstern als bunter Schriftzug: „Metaorganismus“.
Thomas Bosch, weißes Haar, leichter Dreitagebart, bittet in ein weiträumiges Büro. Zahlreiche Fotografien springen ins Auge, auf denen er mit anderen Wissenschaftlern zu sehen ist. Bosch ist international gut vernetzt und man merkt, dass er eine Botschaft hat. Warum ist er so fest davon überzeugt, dass wir ganz neu über die Beziehung zwischen Organismen und Mikroben nachdenken müssen?
„Es gibt in der Natur keine keimfreien, keine bakterienfreien Organismen, aus einem guten Grunde. Die Bakterien waren evolutionsgeschichtlich weit vor uns da, die Erde war 3,5 Milliarden Jahre besiedelt mit einem komplizierten Biofilm aus Bakterien, aus Viren, aus Archaeen und auf diesem und in diesem Biofilm hat sich dann irgendwann ein multizelluläres einfaches Leben entwickelt, wir gehen davon aus, dass das etwa 560-600 Millionen Jahre vor unserer Zeit war, und deswegen ist es im Nachhinein ganz logisch, dass Lebewesen, Gewebe und Lebensprozesse offensichtlich in enger Abhängigkeit von Mikroben ablaufen.“
Vor fünfzehn Jahren war Thomas Bosch noch davon überzeugt, dass ein Organismus dort aufhört, wo seine Körpergrenzen verlaufen. Er forschte damals bereits fast dreißig Jahre lang an dem Süßwasserpolypen Hydra, der zur über 500 Millionen Jahre alten Gruppe der Nesseltiere gehört. Dann veränderte das winzige, schlauchförmige Wesen seinen Blick.
Der Mensch ein „Metaorganismus“
„Das Schlüsselerlebnis war, als ein junger Student zu mir kam mit einem mikrobiologischen Hintergrundwissen. Und wir haben festgestellt, dass wenn wir das Epithel von diesen Tieren sequenzieren oder Zellen sammeln und dann sequenzieren, dass wir immer wieder natürlich die Erbsubstanz von diesen Zellen und dem Gewebe bekommen, aber daneben immer und immer regelmäßig und immer reproduzierbar Sequenzen, die eindeutig zu Bakterien gehören. Das heißt das Gewebe ist ganz tief assoziiert mit ganz bestimmten Bakterien und das war ein Schlüsselerlebnis. Die Arbeit wurde sehr viel zitiert, sie wurde dann verifiziert in vielen anderen Organismen, von Fischen über Säugetiere bis zum Menschen, sodass wir konfrontiert waren mit der für mich völlig erstaunlichen Tatsache, dass alles, was wir an der Hydra anschauen, eigentlich auch mit Bakterien zu tun hat.“
Hydra, alle Tiere und der Mensch sind mehr als ihre Teile. Sie sind „Metaorganismen“, weil ihr Organismus auch die eigenen Mikroben umfasst. Das ist die Idee, der sich Thomas Bosch verschrieben hat und die seit einigen Jahren weltweit immer intensiver erforscht wird. Wobei sich die Wissenschaftler erst allmählich mit Viren oder Pilzen befassen, die bisherige Forschung lief fast ausschließlich an Bakterien. Ein 80 Kilogramm schwerer Mann hat zum Beispiel etwa fünf Kilogramm Bakterien in und auf der Oberfläche seines Körpers und besitzt damit ungefähr genauso viele Körper- wie Bakterienzellen. Thomas Bosch und sein früherer Mitarbeiter Sebastian Fraune konnten zeigen, dass diese Ansammlung von Bakterienzellen keineswegs beliebig ist.
Hydra, alle Tiere und der Mensch sind mehr als ihre Teile. Sie sind „Metaorganismen“, weil ihr Organismus auch die eigenen Mikroben umfasst. Das ist die Idee, der sich Thomas Bosch verschrieben hat und die seit einigen Jahren weltweit immer intensiver erforscht wird. Wobei sich die Wissenschaftler erst allmählich mit Viren oder Pilzen befassen, die bisherige Forschung lief fast ausschließlich an Bakterien. Ein 80 Kilogramm schwerer Mann hat zum Beispiel etwa fünf Kilogramm Bakterien in und auf der Oberfläche seines Körpers und besitzt damit ungefähr genauso viele Körper- wie Bakterienzellen. Thomas Bosch und sein früherer Mitarbeiter Sebastian Fraune konnten zeigen, dass diese Ansammlung von Bakterienzellen keineswegs beliebig ist.
„Für uns war es durchaus überraschend zu entdecken, dass das Mikrobiom artspezifisch ist. Alle Tiere, die wir bei uns im Labor haben, werden unter gleichen Bedingungen gehalten und dann kommt ein junger Mitarbeiter, und sagt, alle diese verschiedenen Spezies haben ein hoch spezifisches, unterschiedliches Mikrobiom. Und dann rutscht dem betreuenden Doktorvater dann schon mal raus, ich glaube dir kein Wort, das kann gar nicht sein, weil wie sollen verschiedene Bakterien da sein, wir halten die Tiere identisch über 10, 15, 20 Jahre. Geh raus ins Freiland und versuche diese Tiere zu finden und versuche herauszufinden, ob sie auch im Freiland diese spezifischen Mikroben haben. Und das hat Sebastian dann gemacht, hat das ähnliche Mikrobiom auch im Freiland gefunden.“
Vom winzigen Süßwasserpolypen Hydra bis zum ausgewachsenen Gorilla leben offenbar alle Arten mit ganz bestimmten Mikroben zusammen. Die Rätselfrage nach dieser Entdeckung hieß: Wie schaffen die das? Wo doch unzählig viele Bakterien allgegenwärtig sind.
„Das hat mich dann dazu gebracht, über die Rolle des Immunsystems nachzudenken, mit dem ich mich schon lange beschäftigt habe und ich bin jetzt der Meinung und habe das entsprechend belegt: Wir und alle Organismen halten unser Mikrobiom in einer sehr spezifischen Art und Weise mithilfe unseres Immunsystems und wir sind der Meinung, dass ein Immunsystem sich entwickelt hat stammesgeschichtlich nicht so sehr zur Abwehr von Krankheitserregern sondern um diesen Komplex, dieses komplexe Gebilde „Metaorganismus“ aufrechtzuerhalten.“
Das Immunsystem sortiert gute und schlechte Mikroben
Eine wichtige Figur im Immunsystem sind kleine Verwandte der Eiweiße, sogenannte Peptide. Schon bei Hydra und anderen uralten Tieren wirken diese Peptide antimikrobiell, sie töten also Bakterien. Warum sie das tun, lag auf der Hand – Dachte man – weshalb die Abwehrhypothese auch niemand hinterfragt hatte:
„Bis wir zu dieser Idee kamen: Natürlich töten sie Bakterien, aber durch das Töten halten sie die ganze Menagerie von verschiedenen Mikroben in einer bestimmten Komposition, in einer bestimmten Zusammensetzung. Wir haben das dann tatsächlich kausal nachgewiesen, indem wir Gene in diesen Tieren ausgeschaltet haben mit gentechnischen Methoden, die für eine Familie von solchen antimikrobiellen Peptiden codieren. Dann können diese Tiere nicht mehr ihr gesundes, ihr normales Mikrobiom zurückbekommen. Das heißt, wenn unser Immunsystem gestört ist, dann ist auch unser ganzer Metaorganismuszusammenhang gestört.“
Das Gewimmel von Mikroorganismen in und auf unserem Körper gehört also irgendwie zu uns und wir teilen es mit all unseren Artgenossen. Halten wir und unsere Mikroben aber wirklich ein Leben lang wie Pech und Schwefel zusammen? Oder gibt es Spielräume? Und was passiert mit uns, wenn wir sie zu weit ausreizen und das sensible Gleichgewicht stören?
Vom Zoologischen Institut geht es über ein kleines Rasenstück hinüber in das amöbenhaft geschwungene Universitätsgebäude. Dort sitzt das Mikrobiomlabor des Instituts für Klinische Molekularbiologie.
Mit diversen Apparaturen werden hier Mikroorganismen und Immunzellen analysiert. Unterstützt wird Laborleiterin Corinna Bang dabei von einem Roboter: Mit mechanischen Bewegungen sortiert er gerade Probenbehälter.
Corinna Bang interessiert sich für die so genannten B- und T-Zellen, die Spähtrupps des Immunsystems. B- und T-Zellen liegen sozusagen ständig auf der Lauer, um eindringende Krankheitskeime rechtzeitig zu erkennen. Sie schicken dann Antikörper los, die diese Erreger angreifen und zerstören. Inzwischen ist jedoch auch klar, dass Mikroorganismen die B- und T-Zellen auch anregen.
Also je mehr molekulare Muster eines Mikroorganismus, umso mehr T-Zellen reifen in den Drüsen heran und werden freigesetzt. B-Zellen insbesondere werden durch bakterielle Stoffwechselprodukte reguliert, das heißt, da gibt es Rezeptoren vor allem im Darm, die zur Aktivierung der B-Zellen führen können und B-Zellen setzen dann ganz allgemeine Antikörper frei, die im Darm so ein bisschen das Gleichgewicht herstellen sollen, wenn auch mal gutartige Bakterien zu viel dort sind.
Bakterien sind also nicht nur feindliche Zielobjekte für Immunzellen, sondern auch ihre Helfershelfer. Bei so viel Wechselwirkung zwischen Mikroben und den Zellen des Organismus wäre es verwunderlich, wenn sich der Metaorganismus nie verändern würde. Tatsächlich kann ihn schon ein mehrmonatiger Aufenthalt in Japan beeinflussen. Es gibt zwar einen bestimmten Pool an Bakterien und Viren, mit denen eine Art zusammenleben kann. Aber innerhalb dieses Rahmens sorgen viele Faktoren dafür, dass jedes Mikrobiom individuell gefärbt ist.
Bakterien sind also nicht nur feindliche Zielobjekte für Immunzellen, sondern auch ihre Helfershelfer. Bei so viel Wechselwirkung zwischen Mikroben und den Zellen des Organismus wäre es verwunderlich, wenn sich der Metaorganismus nie verändern würde. Tatsächlich kann ihn schon ein mehrmonatiger Aufenthalt in Japan beeinflussen. Es gibt zwar einen bestimmten Pool an Bakterien und Viren, mit denen eine Art zusammenleben kann. Aber innerhalb dieses Rahmens sorgen viele Faktoren dafür, dass jedes Mikrobiom individuell gefärbt ist.
„Weniger Sagrotan, mehr Dreck“
„Es ist abhängig von der Genetik eines jeden, es ist abhängig von der Umgebung, in der derjenige lebt und es ist abhängig ganz toll von der Ernährung und den sonstigen Gewohnheiten der Person. Es gibt viele Studien auch zu Zwillingen, die zeigen, dass das Mikrobiom zwar ähnlich ist aber nicht gleich.“
Dabei gilt offenbar: Je freier sich das Mikrobiom entfalten kann, umso gesünder der Organismus. Und: Übertriebene Hygiene und zu viel Antibiotika sind Gift.
„Also es gibt Studien, wenn Kinder Antibiotika bekommen, oft haben Neugeborenen ja leider Infektionen und müssen dann sofort Antibiotika bekommen. Vergleicht man diese Kinder mit Kindern, die eben keine Antibiotika bekommen mussten, haben sie ein deutlich erhöhtes Risiko später an einer chronischen Erkrankung wie einer Allergie oder einer chronischen Darmerkrankung zu erkranken. Als Mutter, muss ich sagen, habe ich mir das auch sehr zu Herzen genommen: weniger Sagrotan, mehr Dreck, mehr Diversität.“
Über das Treppenhaus kommt der Besucher schnell in die Etage, in der Felix Sommer sitzt, Senior Postdoc und gelernter Biologe. Über Aufenthalte in diversen Instituten hat er sich für medizinische Fragen qualifiziert hat. Jetzt forscht er unter anderem über den Einfluss des Mikrobioms auf entzündliche Darmerkrankungen und Fettleibigkeit. Sommer selbst ist ein schlanker großer Mann. Auf seinem Schreibtisch liegen mehrere Artikel. Einer beschreibt, wie er zum ersten Mal ein entscheidendes Molekül entdeckt hat.
Dick durch veränderte Darmflora
„Das war jetzt in Mäusen, in ganz jungen Mäusen, die haben, wenn sie unter einundzwanzig Tage alt sind, eine erhöhte Expression von einem gewissen Rezeptor, der Strukturen von Bakterien erkennen kann. Und das hat zur Folge, dass der Körper, also in dem Fall die Maus, dann gewisse Mechanismen in Gang setzt, die gegen gewisse Bakterien gerichtet ist, sodass dadurch eine Veränderung der Darmbakterienzusammensetzung erfolgt. Und das ist wichtig, weil wenn einem dieser Faktor zum Beispiel fehlt, dann hat man eine veränderte Zusammensetzung an Darmbakterien, die dazu führt, dass Mäuse fettleibig werden oder aber Entzündungen entwickeln.“
Auf den Menschen übertragen hieße das: Etwa im ersten halben Jahr nach der Geburt entscheidet sich, ob ein Organismus ein wirklich gesundheitsförderndes Mikrobiom entwickelt oder nicht. Weitere Forschungen zum Menschen sind nötig, betont Felix Sommer, genauso wie zum Zusammenhang zwischen Mikrobiom und Krebserkrankungen. Dort ist zum Beispiel die Schleimschicht im Darm relevant.
„Die Schleimschicht wird von spezialisierten Darmzellen gebildet, das ist ein Zucker-Protein-Gemisch, das können auch bestimmte Bakterien nutzen um erstens da drin sich festzuhalten, dass sie dort einen Lebensraum vorfinden und wiederum können Sie es auch als Nahrungsmittel nutzen. Wenn diese Interaktion zwischen der Schleimschicht und den Darmbakterien gestört ist, dann kann natürlich auch das Gleichgewicht zwischen all diesen Faktoren aus dem Gleichgewicht kommen: in den meisten Fällen kommt in erster Linie zuerst einmal eine Entzündung und diese Entzündung, wenn die dann länger andauert, führt das meistens dann zu einer entzündungsassoziierten Krebsentstehung.“
All das sind Anhaltspunkte, meint Felix Sommer, die zeigen, wie wichtig das Mikrobiom bei der Tumorentstehung ist. Es könnte helfen, ein altes Problem von Krebstherapien besser zu verstehen..
„Sagen wir ich habe zehn Krebspatienten, ich gebe denen eine Therapie X – warum reagieren nur drei dieser zehn Krebspatienten so auf diese Therapie, dass der Krebs entweder zurückgeht oder unter Kontrolle bleibt und bei den anderen sieben funktioniert das nicht. Und das gleiche eben auch für chronisch entzündliche Darmerkrankungen – entweder über die Mikrobiota oder über gewisse Mutationen oder Konfigurationen im Darmepithel, das ist das, was wir in Zukunft vorantreiben wollen.“
Schon jetzt schießen Firmen aus dem Boden, die mit passenden Kulturen Hilfe versprechen: Das Spektrum reicht von Morbus Crohn über Parkinson bis hin zu Autismus oder Parodontose. Aus Stuhlanalysen wird die bakterielle Zusammensetzung ermittelt, Präbiotika, also gesundheitsfördernde Bakterien sollen dann Abhilfe schaffen. Dabei ist Vieles heute noch Grundlagenforschung. Felix Sommer stößt immer wieder auf überraschende Wendungen, die zeigen, dass die Details noch nicht richtig verstanden sind. Zum Beispiel wenn Mediziner das Mikrobiom eines Gesunden auf eine Kranken übertragen. In Deutschland ist das bisher nur für schweren chronischen Durchfall zugelassen.
„Da wird eine Stuhlprobe von einem vorher gut charakterisierten Probanden genommen, wird dann in Lösung gebracht und dann durch ein Rohr durch die Nase direkt in den Darm gebracht und die Heilungsrate dort für diese Krankheit liegt bei 96 Prozent. Was natürlich für Leute, Probanden oder Patienten, die jahrelang an chronischem Durchfall gelitten haben – so eine Therapie ist natürlich ein Segen. Und wir haben da vor kurzem rausgefunden, dass selbst wenn man diese Lösung, die man hergestellt hat, filtert, sodass man dort eigentlich gar keine Bakterien mehr drin hat, dann hilft das trotzdem noch!“
Bakterien als Mittler evolutionärer Anpassung
Die Treppe im Kieler Zentrum für Molekulare Biologie führt tiefer in die nächste Forschungsabteilung. In das Labor von Eva Stukenbrock. Hier rattert gerade ein Gerät namens Speed Mill.
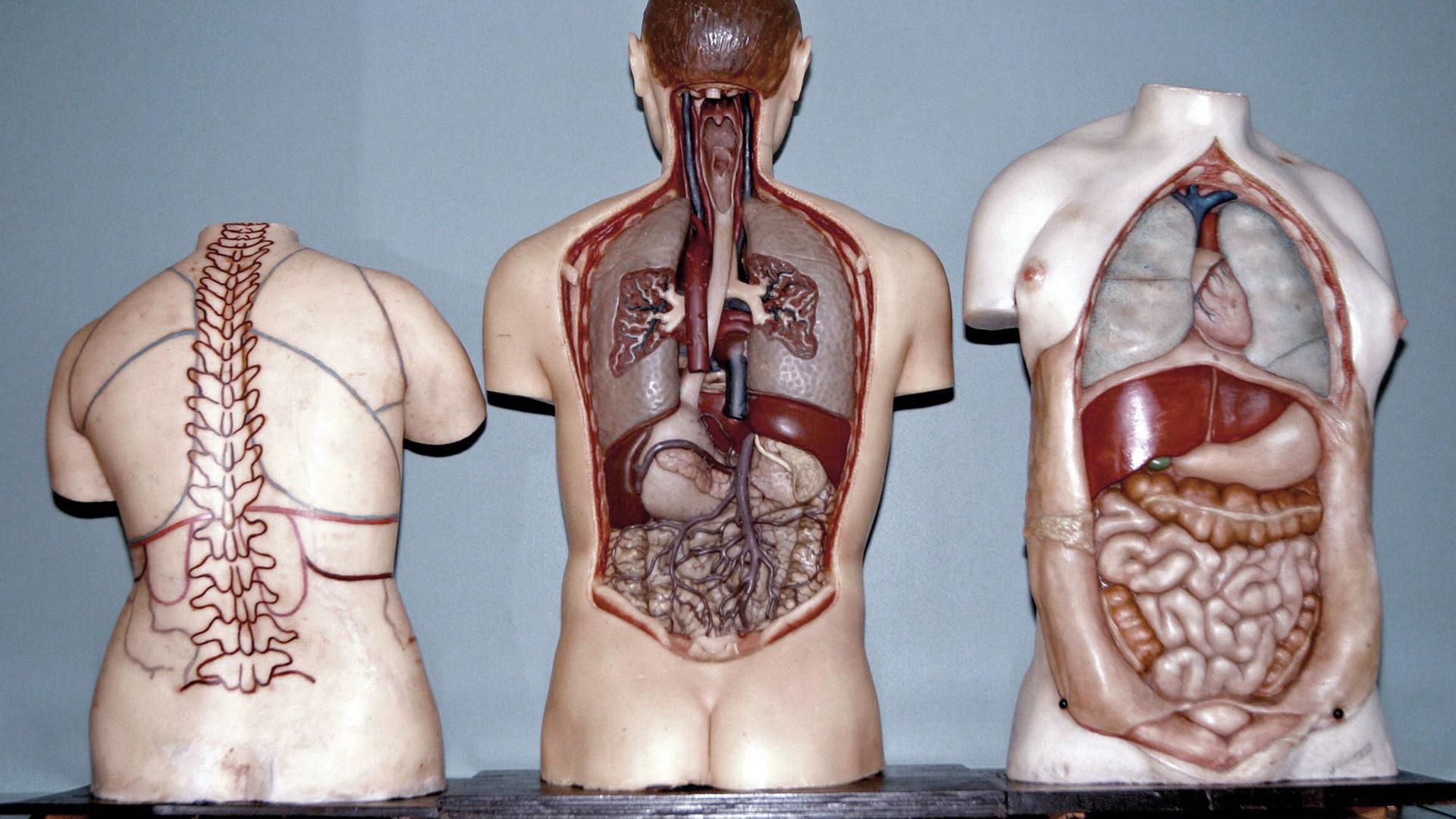
Die Speed Mill schleudert Zellen so heftig hin und her, dass sie aufbrechen. Dann können ihre Chromosomenfäden entnommen und die DNA-Stränge sequenziert werden. Die Gene entscheiden darüber, welche Proteine, also welche Eiweiße im Körper hergestellt werden. Die wiederum prägen das Geschehen in den Zellen und damit die Eigenschaften des ganzen Organismus.
Eva Stukenbrock ist vor einiger Zeit aus Dänemark nach Kiel gekommen. Die junge Wissenschaftlerin macht rasch auf einem Tisch im Vorraum ihres Labors Platz und setzt sich. Wie weit reicht der Arm der Gene? Nur bis zu den eigenen Zellen – oder darüber hinaus?
„Das ist eine supergute Frage. In meiner Arbeitsgruppe arbeiten wir mit mikrobiellen Gesellschaften von Weizen. Es geht ja darum, dass die Organismen zwischen sich eine Ko-Evolution haben und diese Koevolution treibt dann die Evolution von den Proteinen, die in dieser Interaktion eine Rolle spielen.“
„Das ist eine supergute Frage. In meiner Arbeitsgruppe arbeiten wir mit mikrobiellen Gesellschaften von Weizen. Es geht ja darum, dass die Organismen zwischen sich eine Ko-Evolution haben und diese Koevolution treibt dann die Evolution von den Proteinen, die in dieser Interaktion eine Rolle spielen.“
Mikroorganismen passen sich an Weizen an, wodurch wieder Proteine beeinflusst werden, die diese Anpassung fördern. Ein komplexes Wechselspiel. Aber allmählich zeichnet sich ab, was dabei geschieht. Die Gene der Mikroorganismen, die sich an Weizen oder andere Pflanzen anpassen, haben besondere Eigenschaften.
„Was wir herausgefunden haben, ist, dass besonders die Gene, die an dieser Interaktion mit Pflanzen beteiligt sind, die Gene entwickeln sich besonders schnell und oft befinden diese Gene sich auch in spezifischen Bereichen des Genoms mit einer besonders erhöhten Rekombinationsrate und Variation. Das heißt, wenn man eine hohe Rekombinationsrate hat, hat man auch eine hohe Rate, wo neues genetisches Material reingebracht werden kann.“
„Ich bin ganz sicher der Meinung, dass Selektion auf der Metaorganismusebene passiert.“
Die Mikroorganismen sind also gerade dort flexibel, wo das Erbgut den Austausch mit dem Wirt, also dem Weizen organisiert. Gerade hier sind sie für neues Erbgut besonders empfänglich, ihre Anpassung geschieht schnell. Eva Stukenbrock glaubt, dass dadurch der gesamte Metaorganismus in die Lage versetzt wird, rasch auf veränderte Umwelten zu reagieren. Eine Mutation in den Genen eines Mammuts benötigt mindestens 50.000 Jahre, um sich im Erbgut zu festigen. Das dauert zu lange, um etwa mit den harschen Bedingungen nach einem Vulkanausbruch zurecht zu kommen. Wenn das Mammut sein Mikrobíom verändert, könnte er sich dagegen innerhalb von Monaten oder Jahren anpassen. Noch ist das nicht endgültig bewiesen und breit akzeptiert. Es würde aber bedeuten, dass der Metaorganismus eine entscheidende Größe in der Evolution ist.
„Ich bin ganz sicher der Meinung, dass Selektion auf der Metaorganismusebene passiert.“
Das wirft ein ganz neues Licht auf Entwicklungen der Jetztzeit: In der Landwirtschaft versprühen wir seit langem schon Pestizide und andere Giftstoffe. Und die Frage ist, inwieweit das die Vielfalt von Mikroben und Pilzen und damit die Fitness von Wirtspflanzen beeinflusst. Die neuesten Zahlen sind alarmierend.
„Also ich würde sagen, die Ergebnisse, die meine Doktorandin gestern geschickt hat, ganz neu, da würde ich sagen, so dreißig bis vierzig Prozent Reduktion in der Diversität. Müssen wir noch bestätigen, aber auf jeden Fall eine ganz, ganz deutliche Reduktion. "
Botschaften an das Gehirn
Das Genom liefert den Bauplan der Zellen, aus den Zellen formen sich Organe und über allem thront das Gehirn. Selbst das erhält Botschaften aus dem Metaorganismus.
Im eckigen Funktionsbau des Zoologischen Instituts arbeitet in der Abteilung von Thomas Bosch, dem Kopf des Sonderforschungsbereichs, auch Alexander Klimovich. Ein junger Postdoc, er stammt aus Russland. Über den Schreibtisch hat er die Blätter seines neuen Papers verteilt. Thomas Bosch will sie vor der Veröffentlichung noch einmal gegenlesen. Alexander Klimovich bittet daher in einen Nebenraum. Bereits seit längerem gibt es Forschungen zum so genannten „Bauchhirn“. Sie zeigen, dass in der Darmwand ähnliche Nervenzellen sitzen wie im Gehirn. Der Darm unterhält also einen direkten Draht in die Kommandozentrale. Genutzt wird der von den Mikroben. Kann Alexander Klimovitch dem im Rahmen der Metaorganismusidee überhaupt noch etwas hinzufügen?
„Ja, das stimmt, seit etwa fünf Jahren ist es allgemein anerkannt, dass die Darmmikrobiota, also die Bakterien, die unseren Darm besiedeln, das Gehirn beeinflusst und dadurch Auswirkungen auf unser Verhalten, auf menschliche Emotionen hat. Die Metaorganismusforschung erweitert dieses Konzept, wir verstehen diese Darm-Mikrobiom-Hirnachse als ein Paradigma, ein gemeinsames Prinzip, dass generell die Bakterien mit dem Nervensystem reden können. Die symbiotischen Bakterien, egal wo sie sich befinden, nicht nur in dem Darm, auf der Haut beispielsweise, sie können mit dem Nervensystem interagieren.“
Der Vagusnerv, lateinisch für „der umherschweifende Nerv“, heißt so, weil er fast alle Organe des Körpers mitreguliert. Er leitet auch Signale vom Darm zum Gehirn. Alexander Klimovich interessiert sich für die Botenstoffe, die dabei fließen.
„Zu diesen Molekülen gehören zum Beispiel Serotonin oder Acetylcholin oder GABA. Also diese Moleküle sind nicht nur im Nervensystem produziert, die Signale beeinflussen die Aktivität des Gehirns und haben solche Auswirkungen wie Ängstlichkeit oder Depression oder Schmerzempfindlichkeit, also diese Effekte sind vielleicht nicht so dramatisch wie man sich vorstellen kann, aber trotzdem, das sind modulierende Effekte, die doch eine erhebliche Rolle spielen.“
Den Botenstoff GABA können die Darmbakterien exakt so herstellen wie es auch das Gehirn tut. Andere vom Darm produzierte Botenstoffe ähneln den Hirnbotenstoffen nur, aber auch sie sind im Gehirn aktiv.
„Eine der besten Nachweise in diesem Bereich ist, indem man den Vagusnerv einfach durchschneidet, also die Kommunikation ist dann unterbrochen und alle Effekte von Darmmikrobiota, von diesen Neurotransmittern, sind dann auf einmal weg.“
Die Botenstoffe werden dann zwar immer noch im Darm produziert, ihre Signale finden aber nicht mehr den Weg ins Gehirn. Dann empfinden Betroffene nachweislich weniger Schmerz oder Angst. Bekannt ist, dass Darmbakterien auch die Reifung so genannter Mikrogliazellen im Gehirn beeinflussen. Ihr Ausfall wird mit Krankheiten von Alzheimer bis hin zu Psychosen in Verbindung gebracht. – Es ist eine der spannendsten Erkenntnisse der Metaorganismus-Idee: Die Darmflora kann mitverantwortlich gemacht werden für psychische Störungen.
„Wir glauben sogar, dass das Nervensystem dazu entstanden ist, mit Mikrobiota zu reden und sogar Mikrobiota zu kontrollieren“
Um mehr über das Zusammenspiel von Bakterien- und Hirnzellen heraus zu bekommen, hat sich auch Alexander Klimovich intensiv mit dem Süßwasserpolypen Hydra befasst. Das hauchzarte Wesen besitzt an seinem Kopf mehrere Tentakel, mit denen es Plankton und kleine Tiere fängt. Seine Nerven- und Sinneszellen erlauben es ihm, nicht nur Licht und Temperatur zu registrieren, sondern auch chemische und elektrische Reize. Klimovitch analysierte die dreitausend Nervenzellen des uralten Nesseltiers – mit überraschendem Ergebnis.
„Fast alle Nervenzellen bei Hydra besitzen Rezeptoren, die eine Kommunikation mit den Bakterien ermöglichen, also die Nervenzellen bei Hydra sind in der Lage, bakterielle Signale aufzunehmen und zu bearbeiten. Die können auch auf diese Signale antworten. Eine ganze Reihe von antibakteriellen Substanzen wird genau in den Nervenzellen exprimiert, das ist etwas ganz Neues! Also jetzt finden wir molekulare Mechanismen: genau wie redet das Nervensystem mit den Mikrobiota und andersherum, welche Signale bekommt das Nervensystem von den Bakterien.“
„Fast alle Nervenzellen bei Hydra besitzen Rezeptoren, die eine Kommunikation mit den Bakterien ermöglichen, also die Nervenzellen bei Hydra sind in der Lage, bakterielle Signale aufzunehmen und zu bearbeiten. Die können auch auf diese Signale antworten. Eine ganze Reihe von antibakteriellen Substanzen wird genau in den Nervenzellen exprimiert, das ist etwas ganz Neues! Also jetzt finden wir molekulare Mechanismen: genau wie redet das Nervensystem mit den Mikrobiota und andersherum, welche Signale bekommt das Nervensystem von den Bakterien.“
Alexander Klimovich hat das gemeinsam mit Thomas Bosch zu einer gewagten Hypothese über den Ursprung des Nervensystems angeregt.
„Wir glauben sogar, dass das Nervensystem dazu entstanden ist, mit Mikrobiota zu reden und sogar Mikrobiota zu kontrollieren: die Zusammensetzung der Mikrobiota, die Dichte und sogar die räumliche Organisation. Also die Bakterien besetzen bestimmte Nischen auf den Tieren, auf Hydren, auf Menschen: Darmbakterien dürfen nur im Darm vorkommen, das ist ganz schlimm, wenn die Darmwandbakterien auf der Haut oder dem Auge zu finden sind. Also diese räumliche Organisation der Mikrobiota ist ganz wesentlich und das Nervensystem scheint da eine wichtige Rolle zu spielen. Dazu haben wir vor kurzem ein Paper in der Zeitschrift „BioEssays“ veröffentlicht, wo wir explizit vorschlagen: von Anfang an war das Nervensystem nicht nur an der Kontrolle von Beweglichkeit und Verhalten beteiligt, das Nervensystem hat die Funktion der Mikrobiotaüberwachung übernommen.“
„Wir glauben sogar, dass das Nervensystem dazu entstanden ist, mit Mikrobiota zu reden und sogar Mikrobiota zu kontrollieren: die Zusammensetzung der Mikrobiota, die Dichte und sogar die räumliche Organisation. Also die Bakterien besetzen bestimmte Nischen auf den Tieren, auf Hydren, auf Menschen: Darmbakterien dürfen nur im Darm vorkommen, das ist ganz schlimm, wenn die Darmwandbakterien auf der Haut oder dem Auge zu finden sind. Also diese räumliche Organisation der Mikrobiota ist ganz wesentlich und das Nervensystem scheint da eine wichtige Rolle zu spielen. Dazu haben wir vor kurzem ein Paper in der Zeitschrift „BioEssays“ veröffentlicht, wo wir explizit vorschlagen: von Anfang an war das Nervensystem nicht nur an der Kontrolle von Beweglichkeit und Verhalten beteiligt, das Nervensystem hat die Funktion der Mikrobiotaüberwachung übernommen.“
Heute nimmt das Nervensystem Signale sowohl aus dem Körper als auch aus der Umwelt auf und reagiert darauf. Erreichen die Signale „Hunger“ und „Antilope“ das Nervensystem eines Löwen, wird der Löwe die Antilope jagen. Doch vor 600 Millionen Jahren, als die ersten Nervensysteme der Tiere entstanden, gab es keine Antilopen. Die erste Umweltschicht waren Mikroben. Insofern wäre es nur logisch, wenn das Nervensystem ursprünglich die Aufgabe gehabt hätte, die Beziehung zu ihnen zu koordinieren. Noch vor wenigen Jahren hätte es niemand gewagt, eine solche These aufzustellen, inzwischen aber sorgt sie für ernstzunehmende Diskussionen in der ganzen Forschergemeinde.
Was bleibt vom „Selbst“ ohne Bakterien?
Der letzte Weg ist kurz. Er führt zu Thomas Bosch im gleichen Flur. Bosch versprüht gute Laune. Für das Jahr 2018 wurde er zum Fellow des Wissenschaftskollegs Berlin berufen. Das gibt ihm die Möglichkeit, ein Jahr lang sein Konzept des Metaorganismus theoretisch auszuarbeiten. Worauf muss man sich einstellen?
„Eine der Säulen unseres Selbst-Begriffes geht zurück auf einen Kollegen zu Beginn des 20. Jahrhunderts. Der hat dafür auch den Nobelpreis bekommen, Burnet, und der hat gesagt, unser Immunsystem ist unser Verteidiger gegen das „Nicht-Selbst“. Und immer wenn Eindringlinge zu uns kommen, dann haben wir dieses fantastische Immunsystem und das wehrt alles „Nicht-Selbst“ ab. Die neue Metaorganismusforschung zeigt, dass Mikroben, also „Nicht-Selbst“ ein ganz entscheidender Teil unseres Immunsystems ist. Ohne diese Mikroben funktioniert unser Immunsystem nicht und wir sind hilflos gegenüber allen möglichen Eindringlingen, die von außen kommen. Das heißt. eine der Säulen der Argumentation, was ist eigentlich „Selbst“, fällt damit weg, weil einfach: wir können nicht mehr trennen von „Nicht-Selbst“, was die Bakterien zweifellos ohne Zweifel sind, und „Selbst".“
Auch die zweite Säule des biologischen Selbst bröckelt: die Erbsubstanz.
„Wie viel bakterielle Sequenzen finden sich eigentlich in typisch menschlicher Erbinformation und wir haben das publiziert, die Zahl: etwa 37 % der menschlichen Erbsubstanz sind bakterielle Gene oder die wir auf bakterielle Gene zurückführen können. Also unsere Erbsubstanz, die ist auch eine Mischung, da gibt es auch keine Grenze zwischen Mikroben und Mensch.“
Bleibt noch die dritte Säule: das Gehirn, das zum Beispiel steuert, wie ein Organismus fühlt. Auch hier sind die Grenzen nicht mehr eindeutig.
„Wenn Sie eine ängstliche Maus nehmen und das Mikrobiom aus der ängstlichen Maus herausnehmen und in eine keimfreie Maus stecken, die neutral ist, wird diese keimfreie Maus ängstlich werden.“
Heißt das, der Begriff des „biologischen Selbsts“ ist sinnlos geworden?
„Was wir wollen, ist, aufmerksam machen, dass wir althergekommenes Denken vielleicht ein bisschen neu denken müssen, wenn wir komplexe Zusammenhänge wirklich verstehen wollen. Wir geben bewusst keinen alternativen Begriff weil wir gar keinen haben. Aber was ich auch noch anfügen möchte, es verschwinden nicht nur Grenzen in unserem eigenen Körper Ich finde Grenzen müssen auch in unserem akademischen Forschungsdasein und in unserer akademischen Lehre fallen. Wenn wir heute an den Holobionten und den Meta-Organismus erinnern, dann heißt das, wir kehren zurück auf das, was die Biologie und die Medizin immer war, nämlich der Versuch, ein ganzheitliches Verständnis von komplexen Erscheinungen zu bekommen“
Vor etwa hundert Jahren proklamierte der deutsche Entwicklungsbiologe und Nobelpreisträger Hans Spemann bereits, dass alles Spannende an den Grenzen geschehe, an denen Gewebe aufeinander stößt. Thomas Bosch hat sich das auf die Fahnen geschrieben.
„Die Herausforderung der Zukunft wird es sein, in der modernen Biologie, in der Medizin, in der Forschung über Grenzen hinaus zu denken. Und wo wir auch aktiv werden müssen, glaube ich, wir müssen auch die Lehre, die Ausbildung der Studierenden ändern, wir müssen die Studierenden wieder darauf zurückführen, erstens, dass Mikrobiologie ganz wichtig ist, zweitens dass den Blick auf das Ganze zu richten genauso wichtig ist wie die Detailkenntnis zu haben, um damit eben an den Grenzen Neues zu entdecken.“
„Die Herausforderung der Zukunft wird es sein, in der modernen Biologie, in der Medizin, in der Forschung über Grenzen hinaus zu denken. Und wo wir auch aktiv werden müssen, glaube ich, wir müssen auch die Lehre, die Ausbildung der Studierenden ändern, wir müssen die Studierenden wieder darauf zurückführen, erstens, dass Mikrobiologie ganz wichtig ist, zweitens dass den Blick auf das Ganze zu richten genauso wichtig ist wie die Detailkenntnis zu haben, um damit eben an den Grenzen Neues zu entdecken.“