75 Prozent - diese Zahl hat viele Menschen aufgerüttelt. 75 Prozent weniger Insekten in nur 30 Jahren. Im gleichen Zeitraum sprühten viele Bauern mehr Gift auf ihre Äcker. Gegen die Insekten. Gegen bestimmte Insekten.
"Weltweit gehen wirklich große Teile der Ernte an Schädlinge verloren und auch sehr viel an Insektenschädlinge." "Das kann 20 bis 30 Prozent der landwirtschaftlichen Produktion ausmachen. Manchmal sogar 100 Prozent."
Es sind einzelne Insektenarten, die solche Schäden anrichten. Das Gift aber tötet sie alle. Naturschützer sagen: Das ist Wahnsinn. Wir müssen raus aus dieser Sackgasse. Viele Agrar-Fachleute erwidern: Essen für zehn Milliarden – das geht nicht ohne Gift. Wir brauchen bessere Gifte. Gifte, die wirklich nur die Insekten treffen, die sie treffen sollen.
"Deswegen sind natürlich alle immer auf der Suche nach ganz neuen Methoden, die sozusagen diesen Nachteil komplett aufwiegen, indem sie einen ganz anderen Mechanismus haben." Gibt es denn bessere Gifte? "Auf dem Gebiet wurden schon Fortschritte gemacht." "RNAi ist eben so ein ganz anderer Mechanismus." "Das ist eine Technologie, die sehr selektiv ist, die sehr sicher ist."
Ein gefürchteter Schädling aus Übersee
"Die Kartoffel ist einer der wertvollsten Schätze, welche uns die neue Welt jenseits des Oceans geliefert. Sie kann in den meisten Gegenden nicht entbehrt, durch keine andere Culturpflanze ersetzt werden." Juli 1877. Die Zeitschrift "Der Praktische Landwirth".
"Ungeheures Aufsehen machte daher die Nachricht, welche sich zu Ende des vorigen Monates verbreitete, wonach in einem Kartoffelacker bei Mülheim am Rhein (gemeint ist Köln-Mülheim…) der gefährlichste Feind der Kartoffel, der sogenannte Kartoffel- oder Coloradokäfer, welcher in Amerika einheimisch ist und in den dortigen Kartoffelculturen alljährlich ungeheure Verheerungen anrichtet, aufgefunden worden ist."
Alle Bemühungen, den gefürchteten Käfer aus Europa und dem Deutschen Reich fernzuhalten, waren gescheitert. Eine neue Strategie musste her. "Von den vielen Mitteln, die man gegen dieses Insect in Amerika in Anwendung gebracht hat, hat sich verhältnismäßig noch am besten das giftige arsenikessigsaure Kupferoxyd oder Pariser Grün bewährt."

Pestizide und Resistenz - ein ewiges Wettrüsten
Eines der ersten Pestizide überhaupt und der Beginn eines Wettrüstens, bei dem bislang immer wieder der Kartoffelkäfer "Leptinotarsa decemlineata" die Nase vorn hatte, sagt Gregor Bucher; Leiter der Abteilung Evolutionäre Entwicklungsgenetik an der Universität Göttingen: "Bisher haben ja wirklich Insekten gezeigt, dass sie gegen alles resistent werden, was man gegen sie macht."
Zumindest die Insekten, die die Bauern treffen wollen, die sogenannten Schädlinge. Nicht erst seit den Meldungen über das Insektensterben fordern Wissenschaftlerinnen und Naturschützer einen intelligenteren Umgang mit Ackergiften. Chemiefirmen screenen alle möglichen Wirkstoffe, sie probieren die Chemikalien also an verschiedenen Insektenarten aus. Die Anforderungen an neue Mittel sind groß, sagt Gregor Bucher:
"Die Wahrscheinlichkeit, dass man was Neues findet, was nicht tödlich ist, was den Menschen nichts ausmacht, was auch biologisch abbaubar ist, ist so gering, dass man eben wahnsinnig viele Substanzen screenen muss. Das heißt, es wird immer, immer teurer, und deswegen sind natürlich alle immer auf der Suche nach ganz neuen Methoden, die sozusagen diesen Nachteil komplett aufwiegen, indem sie einen ganz anderen Mechanismus haben. RNAi ist eben so ein ganz anderer Mechanismus."
RNAi steht für RNA-Interferenz. Gregor Bucher; und auch Guy Smagghe von der Universität Gent arbeiten daran. "Auch bei diesem Konzept besprüht man die Kartoffelpflanze ganz klassisch, aber mit einem Produkt, das viel sicherer ist für den Menschen und die Umwelt, für Bienen und andere nützliche Organismen."
Käfer-Puppen als Versuchsobjekte
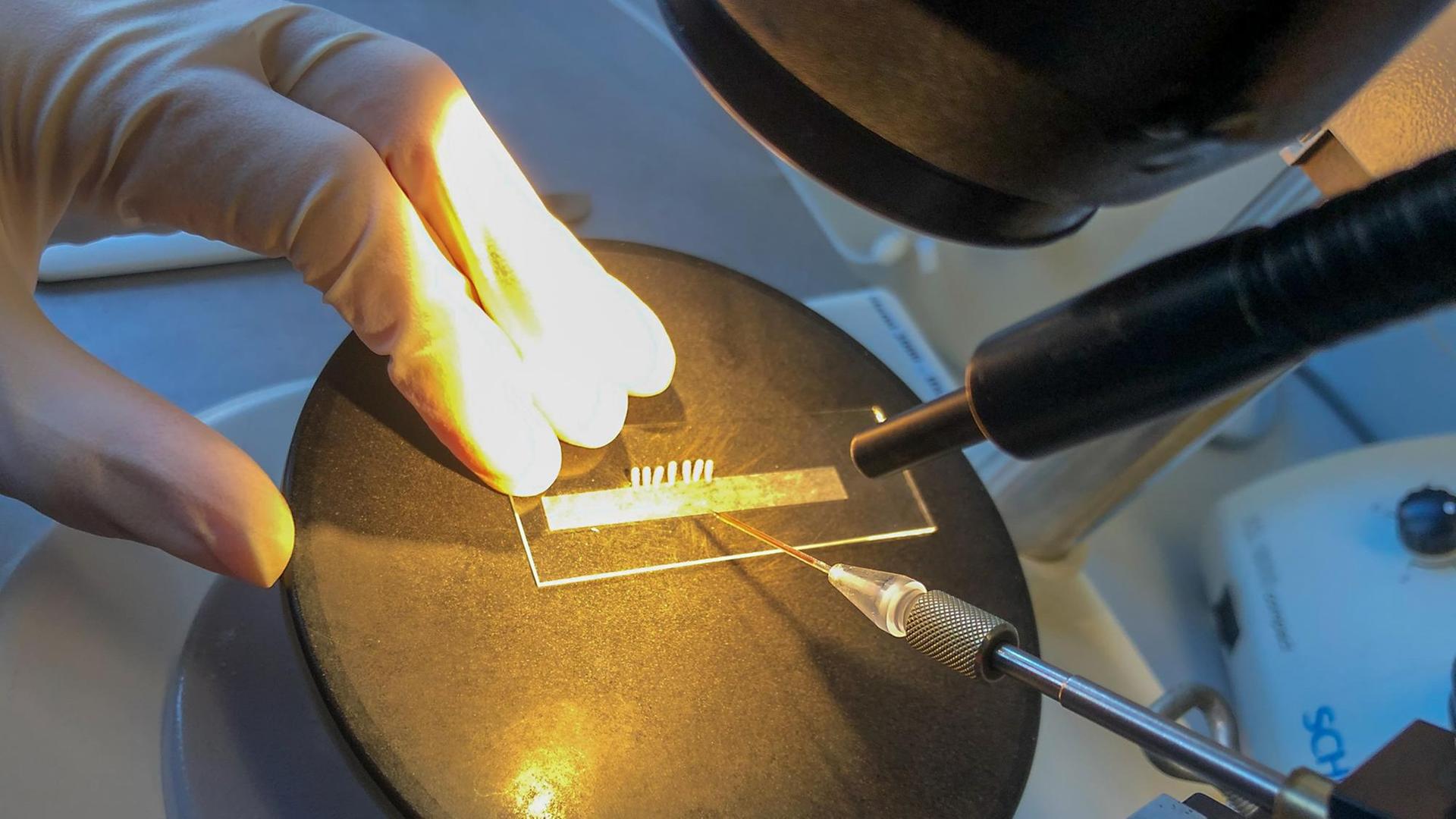
Ein maßgeschneidertes Insektengift ohne Kollateralschäden – kann das wirklich funktionieren? Ein Labor im Ernst-Caspari-Haus an der Universität Göttingen. Annkatrin Müller beugt sich an einem der langen Tische über eine Petrischale. Es müffelt.
"Man riecht ein bisschen die Käfer. Wenn die bewegt werden, dann entlassen die diesen Geruch. So, jetzt liegen die unterm Binokular, es vergrößert nicht so stark wie ein Mikroskop, aber die Puppen sind ja auch relativ groß, deshalb genügt ein Binokular."
Die Biologin hat sich kleine crèmefarbene Möhrchen – gerade einmal gut einen halben Zentimeter lang – aus der Zucht im Keller geholt. Puppen des Reismehlkäfers Tribolium castaneum. Annkatrin Müller greift die Röllchen mit einer Pinzette. "Ich lege mir die an den Streifen hin und dann drücke ich die mit dem Schwanzende auf den Klebestreifen und dann zappeln die zwar noch, aber sind fixiert. Und dann kann man die gut injizieren."

Eine Injektion mit fatalen Folgen
Sieben Stück kleben da in Reih und Glied auf einem Glasplättchen.
"Womit die Puppen injiziert werden, das ist eine sehr dünne Nadel, die ziehen wir selber, das heißt, man hat ein dünnes Glasrohr, und dann wird das erhitzt, sodass es anfängt zu schmelzen, und dann ruckartig auseinandergezogen die beiden Hälften, und dann entsteht eine sehr dünne Spitze. Die wird dann angeschnitten, sodass es eine abgeschrägte Spitze hat. Die Nadel wird dann in einen Stabilisator eingespannt, der sicherstellt, dass die Nadel sich nicht zu stark bewegt, weil die Puppe sehr filigran ist, und mit der Hand würde man zu sehr zittern und dann würde die Puppe reißen."
Annkatrin Müllers Kollege Salim Hakeemi presst so viel der rötlichen Flüssigkeit hinein, bis die Puppe prall gefüllt ist. Der wichtigste Bestandteil: doppelsträngige RNA. Ab jetzt übernimmt die Käferlarve die Arbeit: Sie transportiert die doppelsträngige RNA in die Zellen. Mit fatalen Folgen für den Käfer.
Doppelstrang-RNA macht Immunsystem hellhörig
Im Kern jeder Zelle ist der komplette Bauplan für den Organismus in der DNA gespeichert. Die DNA besteht aus zwei Strängen mit einer bunten Folge von Basen, dargestellt als Buchstaben A, G, C und T. Die Basen der beiden Stränge greifen wie die Zähne eines Reißverschlusses ineinander. Wenn eine Zelle ein Protein herstellen soll, öffnet sie den Reißverschluss und schreibt nur den kurzen Teil der DNA ab, den sie für die Bauanleitung dieses einen Proteins benötigt. Als RNA. Dieser Botenstoff verlässt den Zellkern, und die Zellmaschinerie stellt nach seinem Bauplan Buchstabe für Buchstabe das gewünschte Protein her.
RNA kommt in praktisch jedem Lebewesen auf diesem Planeten vor. Das Besondere: Sie hat lediglich einen einzelnen Strang. RNA ist nur ein halber Reißverschluss. Wenn plötzlich doppelsträngige RNA in einer Zelle auftaucht, wird das Immunsystem hellhörig. Warum, erklärt Gregor Bucher.
"Viele Viren haben als Erbsubstanz eine doppelsträngige RNA. Diese Substanz kommt in einer normalen Zelle eigentlich nicht vor, und die Zelle weiß: Sobald ich doppelsträngige RNA sehe, muss das ein Virus sein, und dann hat die Zelle Proteine, die das erkennen und in kleine Schnipsel zerhäckseln und dann diese Schnipsel als Vorlage nehmen und alles zerstören, was genau wie diese Schnipsel ausschaut."
"Viele Viren haben als Erbsubstanz eine doppelsträngige RNA. Diese Substanz kommt in einer normalen Zelle eigentlich nicht vor, und die Zelle weiß: Sobald ich doppelsträngige RNA sehe, muss das ein Virus sein, und dann hat die Zelle Proteine, die das erkennen und in kleine Schnipsel zerhäckseln und dann diese Schnipsel als Vorlage nehmen und alles zerstören, was genau wie diese Schnipsel ausschaut."
Krankheit erfolgreich abgewehrt – zumindest, wenn da tatsächlich ein Virus in die Zelle eingedrungen ist. "Wenn wir jetzt natürlich eine Doppelstrang-RNA injizieren gegen ein Gen dieses Käfers, dann schaltet der Käfer sozusagen das eigene Gen aus, weil er dachte: Das ist ein Virus."
Mit RNA-Interferenz gezielt Gen ausschalten
Diese Methode heißt RNA-Interferenz oder kurz RNAi. Der US-amerikanische Biologe Andrew Fire und sein Landsmann, der Biochemiker Craig Mello, haben für ihre Entdeckung im Jahr 2006 den Medizinnobelpreis bekommen. Ein interessantes Werkzeug für die Forschung: Wenn die Göttinger Forscher einem Käfer doppelsträngige RNA spritzen, die einem seiner Gene entspricht, kann sein Körper dieses Gen nicht mehr in Proteine übersetzen. Mehr noch: Die Proteinbremse wirkt auch in den Eizellen der weiblichen Käferpuppe. Auch ihre Nachkommen können dieses Protein nicht mehr herstellen.
Ein paar Gänge von Gregor Buchers Labor entfernt untersucht Masterstudent Jan, wie sich die Käferlarven in den Eiern entwickelt haben. Er trägt einen weißen Kittel, sitzt an einer Werkbank und schaut konzentriert ins Binokular. "Ich versuche erst mal, die Eier zu finden, um überhaupt ein Gefühl dafür zu bekommen, wonach genau ich suche. Und dann, wie gesagt, die Strukturen irgendwie zu identifizieren. Das ist am Anfang erstmal ein bisschen Gewöhnungssache. Eine habe ich jetzt gefunden. Ich glaube, das ist eine Wildtyplarve."
Sie sieht ganz normal aus. Jan schiebt ein anderes Ei ins Blickfeld und geht wieder die Merkmale durch. "Okay, Das sieht erheblich anders aus als eben." In diesem Embryo fehlt das Hunchback-Gen, das Buckel-Gen. Dem Studenten ist auf den ersten Blick klar, dass in der Entwicklung der Larve etwas erheblich schiefgegangen ist. "Ich sehe gar keine Beine. Und auch keine weiteren abdominalen Segmente, einfach nur einen relativ einheitlichen Körper. Ohne irgendwelche Anhänge."

Killer-Gene sollten sofort tödlich wirken
Das Hunchback-Gen hat eindeutig gefehlt. Gregor Bucher: "Das Gen ist also offensichtlich nötig, damit sich ein normaler Thorax entwickeln kann. Und von den Mundwerkzeugen sind auch zwei komplett verschwunden, also hat das Gen anscheinend auch dort eine Funktion."
So eine Larve hätte keine Chance, sagt Gregor Bucher. "Die würde im Ei steckenbleiben und würde sterben. Weil das ist natürlich nicht lebensfähig und kann nicht schlüpfen. Das ist bei den meisten Experimenten so und auch bei den meisten Mutanten, die schlüpfen normalerweise nicht und sind dann auch tot." Auch in der Schädlingsbekämpfung will man Insekten töten. Dafür ist das Hunchback-Gen aber ein schlechter Kandidat.
"Das wäre ein sehr schlechtes Gen dafür, weil das adulte Insekt, was diese Doppelstrang-RNA abbekommt, hat überhaupt kein Problem, das heißt, es würde weiter fressen und erst die nächste Generation hätte das Problem. Was wir da bei der Schädlingsbekämpfung wollen, sind Gene, wo das Tier, das frisst, möglichst schnell aufhört zu fressen. Das heißt, es muss in der Larve oder in dem adulten Tier sofort tödlich wirken. Insofern ist das hier interessant für die Grundlagenforschung, aber nicht für die Schädlingsbekämpfung."
RNAi wirkt auf genau einen Schädling
Die RNAi-Methode hat einen riesigen Vorteil gegenüber herkömmlichen Insektengiften: "Der große Vorteil an RNAi in der Schädlingsbekämpfung ist, dass es artspezifisch ist. Man kann diese Chemikalien sprühen und trifft damit nur den Schädling und nicht die Nützlinge. Und das kann man sehr, sehr genau machen. Man kann zum Beispiel wirklich sagen: Ich mache jetzt eine Doppelstrang-RNA, die den Kartoffelkäfer trifft, aber nicht die Biene. Und nicht die anderen Nützlinge."
Denn obwohl Kartoffelkäfer und Biene dieselben Gene haben, mit denen sie ganz ähnliche Proteine herstellen – die Sequenz der Bauanleitung, die in diesen Genen gespeichert ist, die Buchstabenfolge also, ist für jede Art einmalig.
"Man muss diese Doppelstrang-RNA für jeden Organismus neu machen. Will man zum Beispiel im Mehlkäfer das Muskelaktin ausschalten mit so einer Sequenz, dann kann man nicht genau diese Sequenz verwenden für den Kartoffelkäfer, sondern wir machen dann eben für das Kartoffelkäferaktin die entsprechende Sequenz. Und die passt dann wieder hundertprozentig auf den Kartoffelkäfer."
Pflanzen-Forschung bei Monsanto, jetzt Bayer
Auf dem Forschungscampus der Chemieriesen Bayer in St. Louis, Missouri, haben sie oben auf das Parkhaus eine Etage mit einem Gewächshaus gesetzt. Wie eine leuchtende Krone. Bis zur Übernahme durch Bayer hieß diese Firma Monsanto. Das Treibhaus ist in viele Segmente unterteilt. Die Maispflanzen in einem davon sehen schon arg mitgenommen aus. Marc McNabny erklärt, dass dort Versuche laufen: "Das ist kein Fehler. Diese Pflanzen wurden absichtlich getötet."
Marc McNabny ist zuständig für dieses Gewächshaus und die Versuche hier. In einem anderen Segment stehen Reihen von Maispflanzen in einzelnen Töpfen.
"Das sind Spenderpflanzen für einen unserer Umwandlungsprozesse, bei dem wir Embryonen aus den Maissamen benötigen. Darum müssen wir dauernd neue Pflanzen ziehen. Die Leute fragen mich immer: Warum sehen sie aus wie die Orgelpfeifen? Naja, wir benötigen sie jede Woche aufs Neue. Damit sie jede Woche bereit sind, müssen wir sie jede Woche pflanzen."
"Umwandlungsprozess" bedeutet, dass die Bayer-Forscher den Mais-Embryonen neue Eigenschaften geben. "Da fügen wir die Gene ein, die uns interessieren."

Umprogrammierter Mais mit tödlicher Doppelstrang-RNA
In den 90ern haben die Entwickler solchen Maispflänzchen Gene für das Gift des Bakteriums "Bacillus thuringiensis" eingepflanzt. Dieser sogenannte Bt-Mais stellt Gift gegen Insekten her. Fressen sie daran, sterben sie. Vor etwa zehn Jahren haben die Forscherinnen und Forscher begonnen, einen RNAi-Mais zu entwickeln, der doppelsträngige RNA herstellt: MON 87411.
Greg Hack ist Science Strategy Operations Manager bei Bayer in St. Louis. Er vergleicht die Methode mit Computersoftware: "Das ist wie programmieren." Mit dem Mais hacken die Entwickler die Immunabwehr des Maiswurzelbohrers "Diabrotica virgifera virgifera". In den USA heißt das Insekt auch der "Eine-Milliarde-Dollar-Käfer", weil er so große Schäden anrichtet. Seine Larven fressen die Wurzeln der Maispflanzen an. Die Stängel kippen um oder trocknen aus.
Die Entwicklerinnen und Entwickler bei Bayer haben eine ganze Reihe von Genen ausprobiert und sich dann das Gen SNF7 ausgesucht. Wenn die Maiswurzelbohrer-Larven an der Pflanze fressen, nehmen sie die doppelsträngige RNA auf. Ihr Körper schaltet SNF7 ab. "SNF7 ist ein lebenswichtiges Gen für den Maiswurzelbohrer. Er braucht es, um Proteine an der Oberfläche seiner Zellen wiederzuverwerten. Das klingt wenig dramatisch. Wenn dieser Prozess aber stoppt, kann sich der Käfer nicht mehr ernähren, nicht mehr wachsen, er stirbt."
Kombinierte Mechanismen sollen Resistenzen verhindern
Es funktioniert, das hat die Firma gezeigt. Und deshalb in den USA und einigen anderen Ländern bereits eine Zulassung erhalten. "Es wirkt weniger schnell als ein herkömmliches Insektengift, auch weniger schnell als ein Bt-Toxin, aber es ist sehr effektiv."
Aber auch beim Bt zeigten sich schon nach ein paar Jahren Resistenzen. Wieder, muss man sagen, denn das Muster ist lange bekannt: Anfang der 1940er war der Kartoffelkäfer das erste Insekt, gegen das DDT eingesetzt wird. Schon zwei Jahrzehnte später war der Käfer resistent. Pyrethroide, Neonicotinoide – auch diese Waffen werden langsam stumpf. Der Kartoffelkäfer frisst sehr viel, entgiftet sehr effektiv und hat sehr viel Nachwuchs – beste Voraussetzungen für Resistenzen. Schon im Jahr 2008 hatten mehr als 50 Pestizide ihre Wirkung gegen den Kartoffelkäfer verloren.
Inzwischen gehören Untersuchungen zu Resistenzen zum Zulassungsprozess in den Vereinigten Staaten dazu: "Wir haben auf dem Feld, wo wir unseren RNAi-Mais angebaut hatten, die wenigen ausgewachsenen Maiswurzelbohrer eingesammelt, die wir finden konnten. Im Labor haben wir daraus einen resistenten Stamm züchten können. Resistenzen sind also bereits in kleinem Maß vorhanden."
Greg Hack will ihre Ausbreitung verhindern, indem er seinen MON 87411 den Maiswurzelbohrer in die Zange nehmen lässt. "Wir kombinieren mehrere Bekämpfungsmechanismen. Das Produkt, das uns vorschwebt, wird die RNAi-Eigenschaft haben, aber gleichzeitig ein oder mehrere neue Bt-Gifte. Diese unterschiedlichen Mechanismen zusammen können die Resistenzentwicklung unterdrücken." Dass ein Tier gegen zwei ganz unterschiedliche Mechanismen gleichzeitig resistent wird, sei sehr unwahrscheinlich.
Käfer-Gen-Screening in Kooperation mit Bayer
Eigentlich macht Gregor Bucher Grundlagenforschung. Die war beim Reismehlkäfer dringend nötig, denn fast alles, was über die Funktion von Genen in Insekten bekannt ist, wissen Forscherinnen und Forscher aus Versuchen mit der Taufliege Drosophila melanogaster. Was in der Fliege stimmt, kann im Käfer aber falsch sein. Darum haben Gregor Bucher und sein Team im Projekt iBeetle fast sämtliche Gene des Reismehlkäfers durchprobiert. Viele Gene – wie das Hunchback-Gen – erlaubten Rückschlüsse auf ihre Funktion. Andere entpuppten sich als Sackgasse. Zumindest auf den ersten Blick.
"Da gibt es einfach immer so diese 10, 20 Prozent, bei denen die Tiere komplett sofort sterben, bevor sie Nachkommen machen. Was jetzt für uns erst einmal eine Enttäuschung war. Okay, diese Gene, da können wir nichts für die Entwicklungsbiologie lernen, und dann kam die Idee: Ah, stopp mal, das kann man ja verwenden für die Schädlingsbekämpfung, das ist ja eigentlich sogar ziemlich cool, dass die Tiere sofort sterben."
Allerdings hat Gregor Bucher wenig Ahnung von Schädlingsbekämpfung. "Außerdem war es so, dass uns das Geld ausgegangen ist für den Screen. Und wir wollten es gerne weitermachen für unsere Grundlagenforschung und da kam es eben zu dieser Kooperation, wo einerseits Bayer uns ermöglicht, diesen Screen weiterzuführen, wo aber andererseits dann diese tödlichen Gene sofort in die Hände von Leuten kommen, die wissen, was man damit macht und wie man das in die Anwendung bringt, die sich dann sehr dafür interessiert haben."

Kollateralschäden müssen ausgeschlossen werden
Gregor Bucher und sein Team fanden heraus: Bei insgesamt 200 Genen starben die Käfer sehr schnell. Das sind Buchers Kandidaten für RNAi-Insektengifte. Für andere Insekten muss in jedem Fall die Sequenz für die doppelsträngige RNA an die Gene des neuen Tieres angepasst werden.
Die Göttinger Forscher haben übrigens auch drei Gene der Bayer-Leute getestet. Die besten Göttinger Gene wirkten zwei Tage schneller als die aus St. Louis; Kandidaten für den nächsten RNAi-Mais. Ihre Chance sollen sie allerdings erst dann bekommen, wenn Kollateralschäden ausgeschlossen sind.
Guy Smagghe kennt sich aus mit Hummeln, besonders mit der Dunklen Erdhummel "Bombus terrestris". "Ich erforsche schon seit mehr als 20 Jahren die Nebeneffekte von Pestiziden auf Hummeln. Und jetzt auch die von RNAi."
Die Dunkle Erdhummel ist eine wichtige Bestäuberin sowohl für die Landwirtschaft als auch für Wildpflanzen. Der Professor für angewandte Biologie an der Universität Gent in Belgien hat untersucht, ob sich ihr Verhalten ändert, ihre Entwicklung, die Nahrungsaufnahme, wenn sie Kartoffelkäfer-RNA zu fressen bekam. Das war nicht der Fall. "Die Technologie ist also offensichtlich sicher. Es gibt keine negativen Effekte auf dem Niveau des Organismus."
Nebenwirkungs-Check durch Genom-Abgleich
Doch damit hat sich Smagghe nicht zufriedengegeben. Wie präzise sein Kartoffelkäfergift tatsächlich ist, kann er – anders als bei herkömmlichen Insektengiften – bei der RNAi-Methode am Rechner überprüfen. Vor vier Jahren erst haben Kolleginnen und er das komplette Genom der Dunklen Erdhummel sequenziert. Vereinfacht ausgedrückt: Smagghe und sein Team brauchten nur nachzuschauen, ob ein Gen in der Hummel aus genau der Buchstabenkombination besteht, die sie im Kartoffelkäfer verstummen lassen wollen. Dazu haben Bioinformatiker in Smagghes Team Computerprogramme entwickelt.
"Wir haben uns so 20 verschiedene Gen-Produkte, Proteine angeschaut, und haben gesehen, dass es keine Auswirkungen darauf gegeben hat. Das beweist noch einmal, dass wir ganz spezifisch wirksame doppelsträngige RNA entwerfen können."
Das spricht für ihre Sicherheit. Noch andere Eigenschaften zeigen in diese Richtung: In Säugetieren funktioniert die RNAi-Methode nicht. Nicht einmal, wenn wir große Mengen der doppelsträngigen RNA essen würden, könnte sie uns schaden. Enzyme im Mund und Magen zerstören sie, lange bevor sie überhaupt in unsere Zellen gelangen. Auch auf der Haut und im Blut gibt es Mechanismen, doppelsträngige RNA abzubauen. Es hat lange gedauert, Wege um diese Barrieren herum zu finden. Erst seit kurzem gibt es Medikamente auf RNAi-Basis, die zum Beispiel gespritzt werden. [*] Aber Guy Smagghe wollte sichergehen.
"Wir schauen uns damit das menschliche Genom an, das Genom von Mäusen, das Genom von Wasserflöhen, den Daphnien, das Genom der Honigbiene – also von einer Reihe von Organismen, die ein Gift nicht treffen darf. So stellen wir sicher, dass wir diese Buchstabenfolge verwenden können. Das ist eine enorme Arbeit, aber so finden wir wirklich einmalige Gensequenzen, die wir für eine sichere Bekämpfung von Schadinsekten verwenden können."

Keine Akzeptanz für Gentechnik-Pflanzen in Europa
Bayers RNAi-Mais ist eines der ersten Produkte, die doppelsträngige RNA verwenden, um ein Insekt abzuwehren. Die Pflanze lässt Gene im Insekt verstummen, darum heißt diese Methode Host induced gene silencing, kurz HIGS. Guy Smagghe: "Bei HIGS lässt man zum Beispiel eine Wirtspflanze die Produkte herstellen."
Solche Pflanzen zu entwickeln, dauert Jahre. Das können nur große Konzerne. Anwender, die darauf setzen, machen sich von diesen Firmen abhängig. Und in weiten Teilen Europas stehen die Menschen diesen gentechnisch veränderten Pflanzen skeptisch gegenüber, sagt Antje Dietz-Pfeilstetter. Die Biologin forscht am "Institut für die Sicherheit biotechnologischer Verfahren bei Pflanzen" am Julius-Kühn-Institut in Braunschweig.
"Dieser gentechnisch veränderte Mais wird ja bereits seit vielen Jahren auch in zahlreichen Ländern angebaut, allerdings in Europa bisher ausschließlich auf kleinen Flächen in Spanien und Portugal, da ja in Europa die Akzeptanz für gentechnisch veränderte Pflanzen fehlt. Das ist sicherlich ein Hindernis, weil natürlich hier meiner Meinung nach natürlich unbegründet, einfach doch so eine Aversion gegen jegliches Eingreifen in die Ausprägung von Genen besteht."
RNAi-Gifte versprühen ist mittlerweile bezahlbar
Außerhalb Europas ist das anders: Auf 45 Prozent der weltweiten Ackerflächen werden gentechnisch veränderte Pflanzen angebaut. Mit wachsender Tendenz. Bt-Mais, aber auch Bt-Baumwolle; Papaya und Pflaumen, die gegen Pflanzenviren resistent sind. Chinesische Forscher zum Beispiel haben mit der Genschere Crispr/Cas in einem Weizen das Gen für ein Protein ausgeschaltet, ohne das sich Mehltau nicht mehr in dem genom-editierten Getreide einnisten kann. So eine Veränderung hätten sie – weitaus mühsamer – auch mit herkömmlicher Züchtung erzeugen können.
Pflanzen gentechnisch zu verändern ist trotzdem sehr aufwändig. Viel praktischer wäre es, Bäuerinnen und Bauern könnten die maßgeschneiderten Gifte – wie bisher auch – einfach versprühen. "Spray induced gene silencing" oder SIGS heißt das im Fachjargon. Bis vor kurzem standen dem vor allem zwei Hindernisse im Weg, erklärt Gregor Bucher, der Göttinger Entwicklungsbiologe: "Ganz lang dachte man ja, dass die Herstellung von Doppeltstrang-RNA viel zu teuer ist, um es zu sprühen. Und nachdem es ein Biomolekül ist, dass es eben auch zu schnell abgebaut wird, um wirklich für die Anwendung gut zu sein."
"Die Herstellungskosten damals lagen meiner Information nach bei zirka 12.000 Dollar pro Gramm doppelsträngiger RNA, und mittlerweile sind die Produktionskosten auf 0,5 bis ein Dollar pro Gramm gesunken, und ein wichtiger Schritt war offenbar, dass man entsprechende zellfreie Systeme etabliert hat."

Produkte gegen Kartoffelkäfer wohl bald marktreif
Das zweite Hindernis verbirgt sich hinter einem Vorteil: RNA zerfällt in der Umwelt ohne giftige Abbauprodukte. Und das geschieht ziemlich schnell. Darum müssen Landwirtinnen und Landwirte RNAi-Produkte häufiger spritzen als herkömmliche Gifte. Forscher versuchen, die sogenannte Formulierung zu verbessern, also den Molekülen Hilfsstoffe beizumischen, die die doppelsträngige RNA haltbarer machen. Australische Forscher zum Beispiel verpacken die doppelsträngige RNA in winzige Lehm-Partikel, die sie auf Pflanzen sprühen.
Noch etwas darf man nicht vergessen: Die doppelsträngige RNA muss erst einmal überhaupt ins Insekt hineingelangen. Gregor Bucher:
"Ein Käfer, der zufällig auch besprüht wird mit dem Ganzen, solange der nicht an den Pflanzen frisst, hat er kein Problem. Erst wenn er anfängt, diese Doppelstrang-RNA aufzunehmen, also an den Nutzpflanzen zu fressen, erst dann kommt es zur Antwort."
"Ein Käfer, der zufällig auch besprüht wird mit dem Ganzen, solange der nicht an den Pflanzen frisst, hat er kein Problem. Erst wenn er anfängt, diese Doppelstrang-RNA aufzunehmen, also an den Nutzpflanzen zu fressen, erst dann kommt es zur Antwort."
Produkte gegen den Kartoffelkäfer sind schon weit fortgeschritten. Antje Dietz-Pfeilstetter: "Die werden auch tatsächlich von verschiedenen Firmen entwickelt, unter anderem von einem amerikanischen Biotech-Start-up-Unternehmen, sodass sie davon ausgehen, dass dieses Präparat wohl schon in zwei bis drei Jahren auf dem US-Markt zu erwarten ist."
RNAi-Methode funktioniert auch gegen Unkraut und Schimmel
Ganz anders kommt die doppelsträngige RNA beim Kampf gegen die "Citrus greening disease" an ihr Ziel, sagt Guy Smagghe: "Das ist eine sehr originelle Methode, die Bäume werden imprägniert. Das wird in Florida schon kommerziell eingesetzt. Mit einer Injektionspistole presst man eine kleine Menge doppelsträngige RNA in den Stamm."
Über seine Wasserleitungen unter der Rinde verteilt der Baum die doppelsträngige RNA bis in die Blätter. Farmerinnen und Farmer in Florida bekämpfen auf diese Weise den Blattfloh Diaphorina citri. Denn der überträgt das Bakterium, das diese Krankheit auslöst. Die Mikrobe lässt sich bislang nicht bekämpfen, aber je weniger Blattflöhe, desto weniger Übertragung.
Die RNAi-Methode ist nicht auf Insekten beschränkt. Sie funktioniert auch gegen störende Wildkräuter oder Fusarium-Schimmel in Getreide. Dieser Pilz verursacht große Schäden, weil seine Gifte die Ernte unbrauchbar machen. Die Verluste addieren sich pro Jahr auf drei Milliarden US-Dollar.
Wie konkurrenzfähig sind die "besseren Gifte"?
Maßgeschneiderte Gifte, bessere Gifte – ob diese Bezeichnungen zutreffen, hängt davon ab, was der Maßstab ist. Landwirten dürfte wichtig sein, dass sie ihren Zweck erfüllen. Da gibt es erstmal einen kleinen Dämpfer von Gregor Bucher von der Universität Göttingen:
"RNAi wirkt eben nicht so stark wie chemische Pestizide. Das ist natürlich ein Nachteil, an dem kann ich gar nichts ändern, wir versuchen gerade, Methoden zu entwickeln, dass es nochmal 10, 20 Prozent besser funktioniert, aber das ist schon eine Schwäche von RNAi, dass es nicht ganz so stark wirkt wie chemische Pestizide. Ich denke, das muss dann der Markt entscheiden.
Aber wenn sie dafür wirklich nur die Insekten killen, die die Felder kahlfressen? Kein Bauer will ja Bestäuber töten. Für sie spielt noch ein weiteres Argument eine wichtige Rolle, glaubt Guy Smagghe von der Universität Gent: "Entscheidend wird, wieviel die Anwender für das Produkt werden bezahlen müssen."
Genetisch veränderte Pflanzen haben in der EU auf absehbare Zeit keine Chance. Das sehen wohl auch die Hersteller so, denn schon lange gibt es keine Anträge auf Zulassung zum Ausbringen im Freiland mehr.
Zumindest ein Schritt in die richtige Richtung
Beim Sprühen oder Imprägnieren sieht Guy Smagghe bessere Chancen, denn dabei gelangen keine gentechnisch veränderten Organismen in die Umwelt. In Australien fallen RNAi-Sprays unter die Biopestizide. In Europa gibt es diese Kategorie bei der Zulassung gar nicht. Die Europäische Behörde für Lebensmittelsicherheit EFSA hat noch nicht entschieden. Resistenzen dürften auch bei RNAi-Giften bestenfalls eine Frage der Zeit sein.
Und das Insektensterben? Noch einmal Antje Dietz-Pfeilstetter: "Hier kann sicherlich durch RNAi-Pflanzenschutzmittel, die wesentlich spezifischer sind und eben Nicht-Ziel-Organismen eben nicht beeinträchtigen, auf jeden Fall dazu beigetragen werden. Dass es hier eine bessere, positivere Entwicklung gibt und dass das Insektensterben doch zumindest von der Seite her verlangsamt wird."
Ein Schritt in die richtige Richtung. Gregor Bucher: "Es wird sicher nicht die Lösung aller Probleme sein. Aber vielleicht ist es eine der Teillösungen, die in manchen Gebieten anwenden kann, und das ist schon ein schönes Gefühl."
[*] An dieser Stelle ist uns in der Sendefassung ein Fehler unterlaufen, für den wir uns entschuldigen möchten. Anders als ursprünglich behauptet, sind die Hürden für RNAi-Anwendungen in der Medizin hoch, aber nicht unüberwindbar, wie erste Projekte belegen.







