1999. An einem heißen Sommertag an der Universität in Tübingen. Viele Studierende tummeln sich im Freibad. Ingmar Hoerr muss noch arbeiten. Er will unbedingt ein wichtiges Experiment zu Ende bringen. Dann geschieht es.
„Es ist so der Heureka-Moment. Tatsächlich, das gibt es wirklich. Hätte ich auch nicht gedacht, dass es so was gibt.“
Eine RNA hat er als Kontrollprobe verwendet. Sie löst eine Immunreaktion in seinen Versuchstieren aus, stärker als jede DNA. „Innerhalb von Minuten war mir klar: Das ist eine Revolution, die wir da entdeckt haben.“
Vor seinem geistigen Auge sieht Hoerr die Zukunft einer wunderbaren RNA-Medizin: Therapien gegen Herzinfarkt, vererbte Krankheiten, Immunstörungen und sogar Krebs. Was er nicht ahnen kann: dass er seine Erkenntnisse jahrelang wie sauer Bier wird anbieten müssen. Und er ist nicht der einzige mRNA-Visionär, dem es so ergeht. Der Durchbruch muss warten.
„Es ist so der Heureka-Moment. Tatsächlich, das gibt es wirklich. Hätte ich auch nicht gedacht, dass es so was gibt.“
Eine RNA hat er als Kontrollprobe verwendet. Sie löst eine Immunreaktion in seinen Versuchstieren aus, stärker als jede DNA. „Innerhalb von Minuten war mir klar: Das ist eine Revolution, die wir da entdeckt haben.“
Vor seinem geistigen Auge sieht Hoerr die Zukunft einer wunderbaren RNA-Medizin: Therapien gegen Herzinfarkt, vererbte Krankheiten, Immunstörungen und sogar Krebs. Was er nicht ahnen kann: dass er seine Erkenntnisse jahrelang wie sauer Bier wird anbieten müssen. Und er ist nicht der einzige mRNA-Visionär, dem es so ergeht. Der Durchbruch muss warten.
Im Schatten der DNA
Nicht mRNA, sondern das Erbmolekül DNA war 1999 in aller Munde. Das menschliche Genom erstmals vollständig entziffert. Die Gentherapie in Reichweite. Dazu änderten Biotechnologen die DNA. Das Schwestermolekül mRNA galt als Arbeitskopie. Kaum jemand kümmerte sich um sie. Das „m“ von mRNA steht für „messenger“ gleich Bote. mRNA ist die Botin, die weiterträgt, was die Meisterin DNA befiehlt. Also uninteressant.
Nach seinem Heureka-Erlebnis sah Ingmar Hoerr das anders. Er hatte das empfindliche Botenmolekül RNA in den Körper einer Maus gespritzt. Ohne jegliche Verpackung, einfach so. Eigentlich hätte es sofort abgebaut werden müssen, ohne jede Wirkung. Doch die Maus reagierte. In ihren Zellen wurde die Information aus der RNA umgesetzt. Fremdes Protein verließ die mauseigenen Proteinfabriken. Und das Immunsystem der Maus reagierte und bildete Antikörper. Ingmar Hoerr:
„Da war ich wirklich überzeugt, dass man alles Mögliche auf die RNA schreiben kann und der Körper macht genau das, was man ihm sagt.“
„Da war ich wirklich überzeugt, dass man alles Mögliche auf die RNA schreiben kann und der Körper macht genau das, was man ihm sagt.“
Skepsis bei Fachkollegen und Investoren
Leider waren nicht alle so begeistert wie er. Niemand wollte Hoerrs neu gegründete Firma Curevac unterstützen.
„Investoren, die einen wissenschaftlichen Hintergrund haben, die haben alle abgewunken. Auch mit dem Argument: Wenn das so toll ist, dann hätte es längst jemand in Boston oder Harvard gemacht. Das kann gar nichts sein.“
Hoerr erinnert sich an einen wichtigen Investor, der grußlos den Raum verließ, als er seine Ideen vorstellte.
„Ich wurde halt immer als Spinner dargestellt. Leider war es so: Ich war durchdrungen, wie Sie hören. Ich habe von Minute eins gewusst: Da ist eine Revolution im Gange. Ich habe das gesehen und habe versucht, Leute mitzureißen. Und das kann ganz anders laufen. Da gibt es renommierte Professoren zum Beispiel, die sagen: Was ist das für ein durchgeknallter Typ.“
„Investoren, die einen wissenschaftlichen Hintergrund haben, die haben alle abgewunken. Auch mit dem Argument: Wenn das so toll ist, dann hätte es längst jemand in Boston oder Harvard gemacht. Das kann gar nichts sein.“
Hoerr erinnert sich an einen wichtigen Investor, der grußlos den Raum verließ, als er seine Ideen vorstellte.
„Ich wurde halt immer als Spinner dargestellt. Leider war es so: Ich war durchdrungen, wie Sie hören. Ich habe von Minute eins gewusst: Da ist eine Revolution im Gange. Ich habe das gesehen und habe versucht, Leute mitzureißen. Und das kann ganz anders laufen. Da gibt es renommierte Professoren zum Beispiel, die sagen: Was ist das für ein durchgeknallter Typ.“

Impfstoff gegen Corona bringt Durchbruch
Zwei Jahrzehnte später - die Wende. Unerwartet und plötzlich. Eine auf mRNA basierende Impfung zeigte eine Schutzwirkung von 95 Prozent gegen SARS-CoV-2. RNA wurde zum Hoffnungsträger gegen ein Virus, das die Welt in Atem hielt.
Zwei Konkurrenzfirmen, Biontech und Moderna, war das gelungen, wovon Ingmar Hoerr 20 Jahre zuvor geträumt hatte. Eine erfolgreiche RNA-Impfung gegen ein gefährliches Virus. In Mainz konnten die Firmengründer von Biontech jubeln. Özlem Türeci und Uğur Şahin hatten alles auf eine Karte gesetzt, um schneller als andere einen RNA-Impfstoff zu entwickeln. Ein weiteres Heureka der RNA-Forschung.
Özlem Türeci erzählte davon kurz darauf in der regionalen Talk-Show Kölner Treff: „Wir waren schon fast kraftlos vor lauter Aufregung. Und als wir dann gehört haben: Die Impfung funktioniert und sie ist wirklich unerwartet effektiv - 95 Prozent. Es gibt wenige Impfungen, die das schaffen. Da haben wir uns erstmal in den Armen gelegen, haben uns gefreut, sind auf und ab gesprungen und haben uns erstmal einen Tee gegönnt.“
Pandemie als entscheidender Anschub
Das Prinzip ist denkbar einfach: Die RNA transportiert den Bauplan eines Virusproteins in die Muskelzellen hinein. Die beginnen sofort damit, das Virusprotein herzustellen. Das Immunsystem erkennt den Stoff als fremd und organisiert die Abwehr.
Dieses Konzept hatte seit Jahren in den Köpfen der Mainzer RNA-Pioniere herumgespukt. Aber auch ihnen hatte die Unterstützung gefehlt. Jetzt konnten sie ihre Pläne umsetzen. Firmengründer Uğur Şahin hatte anscheinend nur auf den richtigen Moment gewartet:
„Wir hatten 20 Jahre Erfahrung. Wir haben auf unsere Technologie vertraut. Und damit hat man dann auch die Verantwortung, etwas zu tun.“
Seit 2020 gilt RNA als idealer Impfstoff. Überall arbeiten spezialisierte Biotechnologiefirmen inzwischen an mRNA-Vakzinen: gegen die Virusgrippe Influenza, gegen Tollwut, Hepatitis C, Tuberkulose und in einem weltweiten Großprojekt gegen Malaria. Die Welt-Gesundheits-Organisation hat dazu aufgerufen. Die Bill-und-Melinda-Gates-Stiftung sorgt für die Finanzierung. Und Biontech in Mainz für die Entwicklung. Was jahrzehntelang vergeblich versucht wurde, der Sieg über die Malaria, soll nun mit mRNA gelingen.
„Wir hatten 20 Jahre Erfahrung. Wir haben auf unsere Technologie vertraut. Und damit hat man dann auch die Verantwortung, etwas zu tun.“
Seit 2020 gilt RNA als idealer Impfstoff. Überall arbeiten spezialisierte Biotechnologiefirmen inzwischen an mRNA-Vakzinen: gegen die Virusgrippe Influenza, gegen Tollwut, Hepatitis C, Tuberkulose und in einem weltweiten Großprojekt gegen Malaria. Die Welt-Gesundheits-Organisation hat dazu aufgerufen. Die Bill-und-Melinda-Gates-Stiftung sorgt für die Finanzierung. Und Biontech in Mainz für die Entwicklung. Was jahrzehntelang vergeblich versucht wurde, der Sieg über die Malaria, soll nun mit mRNA gelingen.

mRNA "eigentlich" kein gutes Therapeutikum
Der Erfolg in der Pandemie hat anscheinend alle Zweifler überzeugt, auch in der Wissenschaft.
„Ich war dann allerdings selber überrascht, wie gut der Schutz eigentlich ist.“ Jörg Vogel leitet das Institut für Infektionsbiologie der Universität Würzburg. Wenn er über mRNA spricht, benutzt er gerne das Wort eigentlich. „mRNA ist eigentlich kein gut geeignetes Therapeutikum vom Grundansatz her. Aber es funktioniert ganz wunderbar.“
Die Idee, RNA als Informationsträger in Zellen zu bringen, hatte Jörg Vogel überzeugt. Zunächst. Aber Jahrzehnte der Forschung haben ihn vorsichtig gemacht.
"Die Idee ist verlockend, aber es ist eigentlich kein besonders geeignetes Therapeutikum, weil Therapeutika, wie wir sie kennen, meistens sehr klein sind. mRNA-Moleküle sind riesengroß, weshalb man lange daran gebastelt hat, dass man sie überhaupt in Zellen hereinbekommt. Das andere ist, dass mRNA auch nicht besonders stabil ist, wenn sie im Körper ist oder in den Zellen. Das macht sie ja aus. Das liegt in ihrer Natur.”
Die Idee, RNA als Informationsträger in Zellen zu bringen, hatte Jörg Vogel überzeugt. Zunächst. Aber Jahrzehnte der Forschung haben ihn vorsichtig gemacht.
"Die Idee ist verlockend, aber es ist eigentlich kein besonders geeignetes Therapeutikum, weil Therapeutika, wie wir sie kennen, meistens sehr klein sind. mRNA-Moleküle sind riesengroß, weshalb man lange daran gebastelt hat, dass man sie überhaupt in Zellen hereinbekommt. Das andere ist, dass mRNA auch nicht besonders stabil ist, wenn sie im Körper ist oder in den Zellen. Das macht sie ja aus. Das liegt in ihrer Natur.”
RNA ist instabil und braucht Transporter in Zellen
Das doppelsträngige Erbmolekül DNA ist äußerst stabil. Die beiden Stränge stabilisieren sich gegenseitig in der Doppelhelix. Selbst in alten Mammutknochen, die über 10.000 Jahre alt sind, lässt sich DNA nachweisen. Und die gespeicherte Information ist nach Jahrtausenden noch intakt. Bei der einsträngigen RNA ist das anders. Es braucht nicht viel, um eine RNA-Kette zu zerstören. RNA speichert Information nur auf Zeit: manchmal einige Stunden, höchstens ein paar Tage.
Wer im Labor mit mRNA arbeitet, sollte vorsichtig sein und besser auf Gespräche verzichten. Denn jeder Atemzug verbreitet das Enzym RNA-se, das die mRNA sofort in seine Einzelteile zerlegt. Um die RNA geschützt in lebende Zellen zu schleusen, suchten einige Pioniere bereits Jahre vor Ingmar Hoerrs „Heureka“ nach geeigneten Transportern. Denn die RNA den Zellen einfach zum Fraß vorzuwerfen, war keine gute Option.
Marino Zerial erforscht am Max-Planck-Institut für Molekulare Zellbiologie und Genetik in Dresden selbst, wie man RNA am besten in Zellen hineinbringt. Das ist gar nicht so leicht. "Denken Sie nur: Vieles, was wir essen, enthält RNA. Und diese RNA könnte in unsere Zellen gelangen. Das darf nicht geschehen. Die Membran, die alle Zellen umhüllt, ist eine Grenze. Sie wird kontrolliert, ähnlich wie eine Staatsgrenze.“
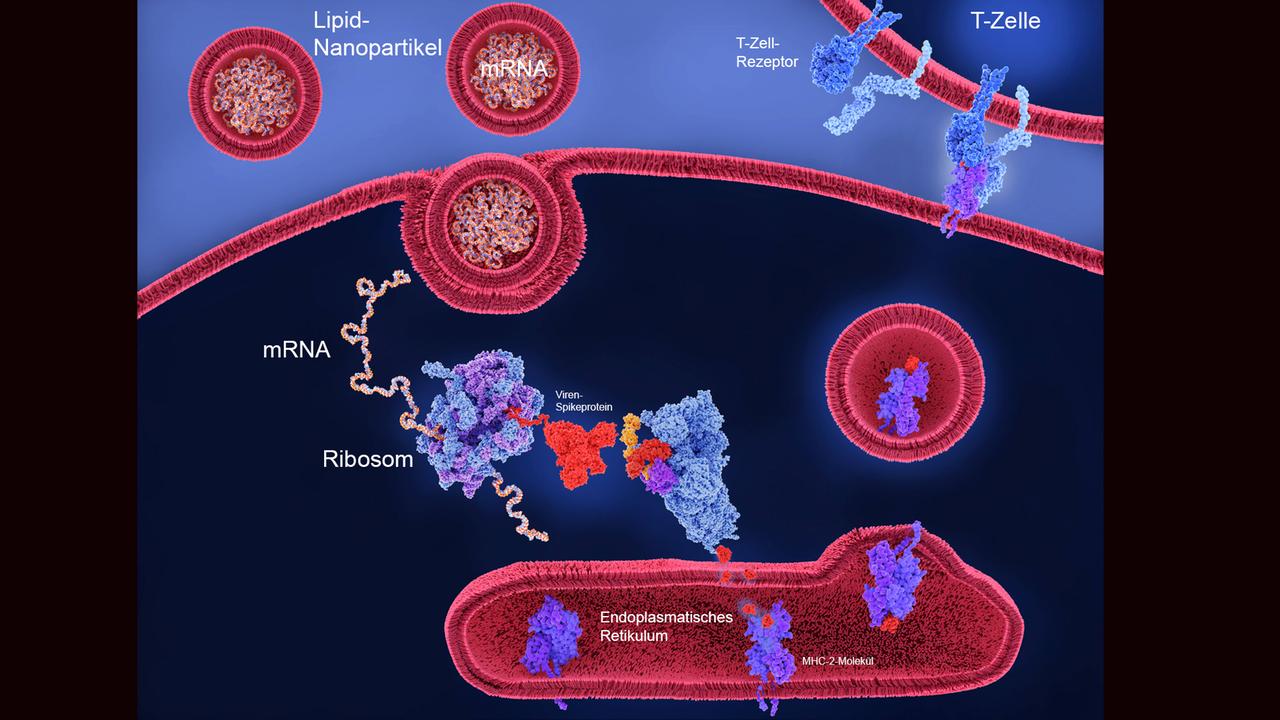
Lipid-Partikel als Einschleusehilfe
Der wahrscheinlich erste Pionier einer RNA-Therapie war Robert Malone, Doktorand am Salk-Institut in Kalifornien. Bereits 1989 – zehn Jahre vor Ingmar Hoerr - mischte er mRNA mit Liposomen. Das sind kleine, runde, natürliche Fettbläschen. Als Transporter. Später wurden sie zu Lipid-Nanopartikeln weiterentwickelt. Auch die mRNA-Impfstoffe werden darin verpackt. Marino Zerial:
„Sie haben Lipid-Nanopartikel hergestellt, die hauptsächlich aus Fetten bestehen. Kleine Fettkügelchen, die mit der mRNA einen Komplex bilden. Sie werden von der Zellmembran erkannt und eingelassen, denn sie sehen ähnlich aus wie Fettkügelchen im Blut.“
Die RNA im Innern der Bläschen gelangte tatsächlich ins Zellinnere. Malone konnte bereits 1989 nachweisen, dass in den Zellen Proteine hergestellt wurden – genau nach dem Bauplan auf der eingeschleusten RNA. Der erste Schritt zu einer mRNA-Therapie schien getan. Es blieb jedoch ein Zufallserfolg, der sich nicht ohne weiteres wiederholen ließ. Marino Zerial hat eine Vermutung, warum das Ganze so schwierig war:
„Falls mRNA in eine Zelle gelangt, wird sie zerlegt und abgebaut. Das geschieht mit der überwiegenden Menge an RNA, die zu medizinischen Zwecken in eine Zelle eingebracht wird. Nur eine winzige Menge kommt durch und gelangt ins Zytoplasma, sodass nach ihrer Information Proteine entstehen.“
„Sie haben Lipid-Nanopartikel hergestellt, die hauptsächlich aus Fetten bestehen. Kleine Fettkügelchen, die mit der mRNA einen Komplex bilden. Sie werden von der Zellmembran erkannt und eingelassen, denn sie sehen ähnlich aus wie Fettkügelchen im Blut.“
Die RNA im Innern der Bläschen gelangte tatsächlich ins Zellinnere. Malone konnte bereits 1989 nachweisen, dass in den Zellen Proteine hergestellt wurden – genau nach dem Bauplan auf der eingeschleusten RNA. Der erste Schritt zu einer mRNA-Therapie schien getan. Es blieb jedoch ein Zufallserfolg, der sich nicht ohne weiteres wiederholen ließ. Marino Zerial hat eine Vermutung, warum das Ganze so schwierig war:
„Falls mRNA in eine Zelle gelangt, wird sie zerlegt und abgebaut. Das geschieht mit der überwiegenden Menge an RNA, die zu medizinischen Zwecken in eine Zelle eingebracht wird. Nur eine winzige Menge kommt durch und gelangt ins Zytoplasma, sodass nach ihrer Information Proteine entstehen.“
Erste Projekte scheitern am Geld
Malone gab schnell auf und wandte sich neuen Forschungsfeldern zu. Andere Wissenschaftler griffen die Idee auf. Sie konnten im Tierversuch das Konzept einer Impfung mit RNA ausprobieren. Und tatsächlich: Sie immunisierten Mäuse mit mRNA gegen Grippeviren. Auch das hätte der Durchbruch sein können, war es aber nicht. Die Forschung wurde nach Projektende eingestellt. Es fehlte das Geld.
Von alldem wusste der junge Doktorand Ingmar Hoerr wenig. Er musste seine mRNA noch nicht einmal verpacken. Die nackte RNA gelangte in die Mäusezellen. Und die Immunzellen der Mäuse reagierten darauf, wie auf ein Virus. Hoerr:
„Wenn irgendwo im Körper RNA vorkommt, fremde RNA, dann kann man davon ausgehen, dass es Viren sind. Das ist ideal für das Immunsystem. Die Zellen wollen wissen: Was ist das für eine RNA? Und sie nehmen sie auf.“
Immunzellen suchen geradezu nach freier RNA, weil sie sie für Viren-RNA halten. Aber das war ihm damals gar nicht bewusst. Ingmar Hoerr hatte also Glück gehabt. Die Immunzellen nahmen die RNA auf. Andere Zellen hätte die nackte RNA nicht erreicht.
Von alldem wusste der junge Doktorand Ingmar Hoerr wenig. Er musste seine mRNA noch nicht einmal verpacken. Die nackte RNA gelangte in die Mäusezellen. Und die Immunzellen der Mäuse reagierten darauf, wie auf ein Virus. Hoerr:
„Wenn irgendwo im Körper RNA vorkommt, fremde RNA, dann kann man davon ausgehen, dass es Viren sind. Das ist ideal für das Immunsystem. Die Zellen wollen wissen: Was ist das für eine RNA? Und sie nehmen sie auf.“
Immunzellen suchen geradezu nach freier RNA, weil sie sie für Viren-RNA halten. Aber das war ihm damals gar nicht bewusst. Ingmar Hoerr hatte also Glück gehabt. Die Immunzellen nahmen die RNA auf. Andere Zellen hätte die nackte RNA nicht erreicht.
"Körper stellt seine eigenen Medikamente her"
Heute wissen wir: Auch mit seiner Schlussfolgerung lag er richtig. Er wusste sofort, dass dies nicht nur ein spannendes Ergebnis für seine Doktorarbeit war, sondern ein Konzept für eine Impfung und für zukünftige Therapien. Das Konzept verfolgt er bis heute:
„Also es ist praktisch nicht so, dass eine Pharmaindustrie das Medikament herstellt, sondern die Pharmaindustrie stellt nur die Sprache, das Buch her, die der Körper lesen kann. Und der Körper stellt dann seine eigenen Medikamente her. Das ist die große Disruption oder Revolution.“
Muskelschwäche, schrumpfende Nervenzellen, Blutarmut oder verschleimte Lungen. 10.000 solcher „seltenen“ Erkrankungen wurden bislang aufgelistet. 80 Prozent davon werden durch kleine Fehler im Erbgut verursacht. Die bekanntesten sind die Mukoviszidose oder die Duchenne-Muskeldystrophie. Bei diesen Krankheiten fehlen bestimmte Proteine oder sie sind fehlerhaft. Jedenfalls können sie ihren Job nicht erledigen. Da bietet sich die mRNA geradezu an als ideale Therapie. Sie könnte die Baupläne für die fehlenden oder defekten Proteine liefern.
„Also es ist praktisch nicht so, dass eine Pharmaindustrie das Medikament herstellt, sondern die Pharmaindustrie stellt nur die Sprache, das Buch her, die der Körper lesen kann. Und der Körper stellt dann seine eigenen Medikamente her. Das ist die große Disruption oder Revolution.“
Muskelschwäche, schrumpfende Nervenzellen, Blutarmut oder verschleimte Lungen. 10.000 solcher „seltenen“ Erkrankungen wurden bislang aufgelistet. 80 Prozent davon werden durch kleine Fehler im Erbgut verursacht. Die bekanntesten sind die Mukoviszidose oder die Duchenne-Muskeldystrophie. Bei diesen Krankheiten fehlen bestimmte Proteine oder sie sind fehlerhaft. Jedenfalls können sie ihren Job nicht erledigen. Da bietet sich die mRNA geradezu an als ideale Therapie. Sie könnte die Baupläne für die fehlenden oder defekten Proteine liefern.
Immer wieder versuchte Ingmar Hoerr, Geldgeber für diese Idee zu begeistern. Lange Zeit vergeblich. Die Dotcom-Blase war geplatzt und Fachleute wussten nur zu gut, was alles schiefgehen konnte.
„Die einzigen Leute, die sich überzeugen ließen, waren die Nicht-Wissenschaftler. So jemand wie Dietmar Hopp, der aus der IT-Branche kam. Das ist genau der Punkt. Wir bewegen uns eher in der IT-Branche als in der von Biologie und Medizin, weil wir sozusagen mit dem Körper sprechen können. Wir haben eine Sprache gefunden, die der Körper versteht.“
„Die einzigen Leute, die sich überzeugen ließen, waren die Nicht-Wissenschaftler. So jemand wie Dietmar Hopp, der aus der IT-Branche kam. Das ist genau der Punkt. Wir bewegen uns eher in der IT-Branche als in der von Biologie und Medizin, weil wir sozusagen mit dem Körper sprechen können. Wir haben eine Sprache gefunden, die der Körper versteht.“

RNA stabilisieren nach natürlichem Vorbild
Jahrelang arbeitete Hoerr daran, die unverpackte RNA stabiler zu machen. Nur so schien es ihm möglich, dass genug RNA in die Zellen gelangt, um ausreichend heilende Proteine zu erzeugen. Dabei orientierte er sich an der Natur:
„Da gibt es RNAs, die natürlich stabil sind, ohne dass sie chemisch modifiziert sind. Und RNAs, die sehr instabil sind, die nach wenigen Minuten wieder zerfallen. Und wenn man vergleicht, was das ausmacht, kann man Muster erkennen, die die RNA stabilisieren, und Muster, die die RNA instabilisieren. Und an diesen Mustern habe ich mich entlang gehangelt.“
Zum einen ist es die Auswahl der einzelnen Bausteine, die die RNA stabiler macht. Mit den richtigen Bausteinen in der richtigen Reihenfolge verknäuelt sich der dünne RNA-Faden und ist nicht mehr so leicht zu durchtrennen. Außerdem entdeckte Ingmar Hoerr typische Bindungsstellen auf der RNA, wo Proteine andocken können. Auch durch sie wird RNA weniger empfindlich.
„RNA im Körper ist niemals nackt. Sie ist immer verbunden mit gewissen Proteinen, bestimmten Eiweißstoffen. Und dadurch wird die RNA im Körper stabilisiert. Also bin ich davon ausgegangen: Wenn ich das mache, dann wird meine RNA auch stabilisiert werden. Und so hat es auch funktioniert.“
„Da gibt es RNAs, die natürlich stabil sind, ohne dass sie chemisch modifiziert sind. Und RNAs, die sehr instabil sind, die nach wenigen Minuten wieder zerfallen. Und wenn man vergleicht, was das ausmacht, kann man Muster erkennen, die die RNA stabilisieren, und Muster, die die RNA instabilisieren. Und an diesen Mustern habe ich mich entlang gehangelt.“
Zum einen ist es die Auswahl der einzelnen Bausteine, die die RNA stabiler macht. Mit den richtigen Bausteinen in der richtigen Reihenfolge verknäuelt sich der dünne RNA-Faden und ist nicht mehr so leicht zu durchtrennen. Außerdem entdeckte Ingmar Hoerr typische Bindungsstellen auf der RNA, wo Proteine andocken können. Auch durch sie wird RNA weniger empfindlich.
„RNA im Körper ist niemals nackt. Sie ist immer verbunden mit gewissen Proteinen, bestimmten Eiweißstoffen. Und dadurch wird die RNA im Körper stabilisiert. Also bin ich davon ausgegangen: Wenn ich das mache, dann wird meine RNA auch stabilisiert werden. Und so hat es auch funktioniert.“
RNA mit chemischer Modifikation tarnen
Auch andere suchten nach Methoden, um die RNA zu schützen und langlebiger zu machen. Und wurden fündig. Uğur Şahin und Özlem Türeci von Biontech zum Beispiel setzten auf ein Verfahren, das in den USA entwickelt worden war. Hoerr:
„Die verwenden eine chemisch modifizierte RNA. Der Hauptkontext dabei ist nicht die Stabilität, sondern dass das Immunsystem die RNA nicht als fremd erkennt. Das ist der Hauptunterschied zwischen der Curevac-Technologie und der Technologie von Biontech und Moderna. Bei der Curevac-Technologie ist es so, dass unsere RNA einer viralen RNA ähnelt, also eine starke Immunantwort hervorruft. Die Biontech- und Moderna-RNA ist so, dass das Immunsystem sie nicht sofort erkennt als fremd.“
Die Curevac-RNA löst eine stärkere Immunreaktion aus. Deshalb musste und durfte sie nicht so hoch dosiert werden wie die RNA von Biontech und Moderna. Eigentlich gut geeignet für eine Impfung.
„Die verwenden eine chemisch modifizierte RNA. Der Hauptkontext dabei ist nicht die Stabilität, sondern dass das Immunsystem die RNA nicht als fremd erkennt. Das ist der Hauptunterschied zwischen der Curevac-Technologie und der Technologie von Biontech und Moderna. Bei der Curevac-Technologie ist es so, dass unsere RNA einer viralen RNA ähnelt, also eine starke Immunantwort hervorruft. Die Biontech- und Moderna-RNA ist so, dass das Immunsystem sie nicht sofort erkennt als fremd.“
Die Curevac-RNA löst eine stärkere Immunreaktion aus. Deshalb musste und durfte sie nicht so hoch dosiert werden wie die RNA von Biontech und Moderna. Eigentlich gut geeignet für eine Impfung.
Aber es kam anders. Die Impfungen von Biontech und Moderna erwiesen sich als deutlich wirksamer. Sie erreichten 95 Prozent, statt der 48 Prozent von Curevac.

Hartnäckige Forscherin in der vermeintlichen Sackgasse
Vermutlich war die chemische Modifikation der RNA dafür verantwortlich. Erfunden hat sie die aus Ungarn stammende Biochemikerin Katalin Karikó: „Das gibt mir schon zu denken. Jetzt bin ich damit beschäftigt, Preise einzusammeln. Vorher habe ich es vierzig Jahre lang versucht und nie einen Penny bekommen.“
Viele Jahre forschte Katalin Karikó an der Universität von Pennsylvania in den USA. Immer wieder beantragte sie Projektgelder und jedes Mal wurden die Anträge abgelehnt. Auch ihren Traum, Professorin an der Universität zu werden, musste Katalin Karikó aufgeben. DNA war gefragt, nicht mRNA.
„Wir haben eine Menge Tierexperimente durchgeführt, mit Schweinen und anderen Tieren. Das war eine große Herausforderung. Aber wir konnten die Wirksamkeit der mRNA nicht beweisen. In Zellkulturen sahen wir einen Effekt. Aber am lebenden Tier passierte nichts.“
Katalin Karikó gab nicht auf. Sie blieb bei ihrer mRNA. Längst galt sie als dickköpfig. Eine Forscherin in der Sackgasse. Doch im Jahr 2005 änderte sich das.
„All diese Studien liefen also. Und da traf ich Drew Weissman am Kopierer im Institut. Wirklich. Ich sprach ihn an und er erzählte mir, er komme von den staatlichen Gesundheitsinstituten und dass er gemeinsam mit Antony Fauci an einem Impfstoff gegen HIV arbeite. Mit DNA und so weiter. Und ich sagte: Ich könne ihm die passende mRNA liefern.“
Viele Jahre forschte Katalin Karikó an der Universität von Pennsylvania in den USA. Immer wieder beantragte sie Projektgelder und jedes Mal wurden die Anträge abgelehnt. Auch ihren Traum, Professorin an der Universität zu werden, musste Katalin Karikó aufgeben. DNA war gefragt, nicht mRNA.
„Wir haben eine Menge Tierexperimente durchgeführt, mit Schweinen und anderen Tieren. Das war eine große Herausforderung. Aber wir konnten die Wirksamkeit der mRNA nicht beweisen. In Zellkulturen sahen wir einen Effekt. Aber am lebenden Tier passierte nichts.“
Katalin Karikó gab nicht auf. Sie blieb bei ihrer mRNA. Längst galt sie als dickköpfig. Eine Forscherin in der Sackgasse. Doch im Jahr 2005 änderte sich das.
„All diese Studien liefen also. Und da traf ich Drew Weissman am Kopierer im Institut. Wirklich. Ich sprach ihn an und er erzählte mir, er komme von den staatlichen Gesundheitsinstituten und dass er gemeinsam mit Antony Fauci an einem Impfstoff gegen HIV arbeite. Mit DNA und so weiter. Und ich sagte: Ich könne ihm die passende mRNA liefern.“
Kleine chemische Variation mit großem Effekt
Die beiden wurden ein Team. Katalin Karikó hatte nun Zugang zu einem größeren Labor. Gemeinsam mit dem Immunologen Weissman gelang es ihr, die mRNA umzubauen. Eine Art Verkleidung, mit der die mRNA im Körper incognito unterwegs sein konnte.
„Ich habe versucht, die Struktur der RNA zu verändern und am Ende als Ersatz für einen RNA-Baustein das Pseudo-Uridin eingebaut. Die RNA wurde nun nicht mehr vom Immunsystem als fremd erkannt und löste keine Entzündungen mehr aus. Sie blieb stabil und ich konnte mit mRNA medizinisch wirksame Proteine herstellen.“
Einige Biotechnologieunternehmen erkannten die Bedeutung. Eine hat sich sogar danach benannt. Moderna klingt wie „modern“, leitet sich aber ab von „Modifizierter RNA“.
Auch Katalin Karikó zog es ein paar Jahre später, 2013, von der Universität in die Biotechnologie. Aus den USA nach Deutschland. Sie wollte Heilmethoden für Patienten entwickeln und ging nach Mainz zu Biontech, um dort ihre Idee in die Praxis umzusetzen. Ihre modifizierte RNA steckt in den Coronaimpfstoffen von BioNTech und Moderna.
„Die Modifikation der RNA haben wir nicht für eine Impfung entwickelt. Das war nur Zufall. Es ging um therapeutische Wirkstoffe. Ich wollte Immunreaktionen und Entzündungen verhindern. Da gab es so viele Drehungen und Wendungen.“
„Ich habe versucht, die Struktur der RNA zu verändern und am Ende als Ersatz für einen RNA-Baustein das Pseudo-Uridin eingebaut. Die RNA wurde nun nicht mehr vom Immunsystem als fremd erkannt und löste keine Entzündungen mehr aus. Sie blieb stabil und ich konnte mit mRNA medizinisch wirksame Proteine herstellen.“
Einige Biotechnologieunternehmen erkannten die Bedeutung. Eine hat sich sogar danach benannt. Moderna klingt wie „modern“, leitet sich aber ab von „Modifizierter RNA“.
Auch Katalin Karikó zog es ein paar Jahre später, 2013, von der Universität in die Biotechnologie. Aus den USA nach Deutschland. Sie wollte Heilmethoden für Patienten entwickeln und ging nach Mainz zu Biontech, um dort ihre Idee in die Praxis umzusetzen. Ihre modifizierte RNA steckt in den Coronaimpfstoffen von BioNTech und Moderna.
„Die Modifikation der RNA haben wir nicht für eine Impfung entwickelt. Das war nur Zufall. Es ging um therapeutische Wirkstoffe. Ich wollte Immunreaktionen und Entzündungen verhindern. Da gab es so viele Drehungen und Wendungen.“

Richtige mRNA-Dosierung ist entscheidend
Der Höhenflug in der Pandemie war nur der Anfang. Durch Baupläne für bestimmte Proteine, geschrieben in mRNA, lässt sich das Immunsystem auch anderweitig regulieren, was bei Therapien gegen Rheuma oder Multiple Sklerose erforderlich ist. Auch der Cholesterinspiegel lässt sich senken mit passenden biologischen Anweisungen auf der mRNA. Für all diese Ansätze gilt eine Grundregel, die Marino Zerial vom Max-Planck-Institut in Dresden formuliert:
„Wenn Sie zum Beispiel die RNA in ein bestimmtes Organ bringen wollen, um etwas zu reparieren oder einen Mangel auszugleichen, dann muss die Methode effizient sein. Dann müssen Sie nicht nur ein paar Zellen erreichen, sondern alle.“
Es sollte aber auch nicht zu viel mRNA sein. Auf die Dosierung kommt es an. Die mRNAs müssen in der richtigen Menge genau in die Zellen gelangen, in denen sie gebraucht werden. Eine Schlüsselrolle dabei spielt ein Verteilungssystem, das Marino Zerial und sein Team genau untersucht haben: die Endosomen.
„Das funktioniert wie in einem Postamt. Dort werden Nährstoffe verteilt, auf verschiedene Bereiche der Zelle. Manchmal findet auch eine Art Recycling statt. Das ist wirtschaftlich sinnvoller, als Unbrauchbares einfach zu zerstören. Alles kann mehrfach wiederverwendet werden.“
„Wenn Sie zum Beispiel die RNA in ein bestimmtes Organ bringen wollen, um etwas zu reparieren oder einen Mangel auszugleichen, dann muss die Methode effizient sein. Dann müssen Sie nicht nur ein paar Zellen erreichen, sondern alle.“
Es sollte aber auch nicht zu viel mRNA sein. Auf die Dosierung kommt es an. Die mRNAs müssen in der richtigen Menge genau in die Zellen gelangen, in denen sie gebraucht werden. Eine Schlüsselrolle dabei spielt ein Verteilungssystem, das Marino Zerial und sein Team genau untersucht haben: die Endosomen.
„Das funktioniert wie in einem Postamt. Dort werden Nährstoffe verteilt, auf verschiedene Bereiche der Zelle. Manchmal findet auch eine Art Recycling statt. Das ist wirtschaftlich sinnvoller, als Unbrauchbares einfach zu zerstören. Alles kann mehrfach wiederverwendet werden.“
Immunsystem auf Krebszellen lenken
Die RNA braucht den richtigen Aufkleber, damit die Endosomen sie nicht schreddern, sondern die Botschaft an die richtige Adresse schicken. Dort dient sie dann als Bauplan für Proteine. Das können verschiedene biologische Strukturen oder Enzyme sein, aber auch genetische Werkzeuge wie CRISPR-Cas. Sie würden vor Ort nach dem Bauplan auf der mRNA zusammengebaut, bevor sie mit ihrer Reparaturaufgabe beginnen. So könnte die RNA sogar dabei helfen, die DNA zu verändern. Es wäre eine Gentherapie, in Gang gesetzt durch RNA.
Diese Ansätze stecken noch in den Kinderschuhen. Andere Verfahren zur Bekämpfung veränderter Zellen – also Krebs – sind bereits ausgereifter und wurden in kleinen klinischen Studien erprobt. Peter Brossart vom Universitätsklinikum Bonn: „Aber das wird noch ein paar Jahre dauern und es wird mit Sicherheit einer Kombination bedürfen.“
mRNA kann das Immunsystem auf Krebszellen lenken. Spezialisten wie Brossart haben erste Ideen bereits in den 1990er-Jahren ausprobiert: „Da haben wir tatsächlich gesehen, dass es einige Patienten gibt, bei denen sich die Symptome bessern und dass auch der Tumor kleiner wird. Und wir haben gesehen, dass man sehr starke T-Zell-Antworten bei den Patienten bekommt, was wir in den vorherigen Impfungen nicht so gesehen haben.“
mRNA kann das Immunsystem auf Krebszellen lenken. Spezialisten wie Brossart haben erste Ideen bereits in den 1990er-Jahren ausprobiert: „Da haben wir tatsächlich gesehen, dass es einige Patienten gibt, bei denen sich die Symptome bessern und dass auch der Tumor kleiner wird. Und wir haben gesehen, dass man sehr starke T-Zell-Antworten bei den Patienten bekommt, was wir in den vorherigen Impfungen nicht so gesehen haben.“

Euphorie, Finanzierungsprobleme und neue Wege
Peter Brossart war an der Universität Tübingen dabei, als Krebsärzte verpackte mRNA genutzt haben, um bestimmte Immunzellen außerhalb des Körpers in der Petrischale scharf zu machen. Die sogenannten Dendritischen Zellen sollten zurück in den Körper und dort die Immunantwort gegen den Krebs organisieren.
Dieses Verfahren hatte Eli Gilboa 1996 in den USA entwickelt. Wie schon bei vielen anderen Immuntherapien waren die Ärzte euphorisch gestartet, um dann festzustellen, dass die Methode zu aufwendig war und nur wenigen helfen konnte.
„Zu der Zeit war das für solche Studien ganz schwierig, Geld zu bekommen, weil kaum Geldgeber da waren, die bereit waren, genug Geld auszugeben. Erstens. Und zweitens viele der Gutachter, die diese Projekte begutachtet haben, an diese Projekte gar nicht mehr geglaubt haben.“
Erst viele Jahre später entwickelten Firmen wie Biontech neue Wege der Immuntherapie gegen Krebs. Durch Fortschritte bei der Erbgut-Sequenzierung war es nun möglich, jeden Tumor einzeln zu charakterisieren. Sobald typische Erkennungsmerkmale auf den Tumorzellen bekannt waren, ließ sich mit mRNA ein individualisierter Impfstoff herstellen. Für jeden einzelnen Patienten und sogar für jeden Tumor. Und das innerhalb weniger Wochen.
„Zu der Zeit war das für solche Studien ganz schwierig, Geld zu bekommen, weil kaum Geldgeber da waren, die bereit waren, genug Geld auszugeben. Erstens. Und zweitens viele der Gutachter, die diese Projekte begutachtet haben, an diese Projekte gar nicht mehr geglaubt haben.“
Erst viele Jahre später entwickelten Firmen wie Biontech neue Wege der Immuntherapie gegen Krebs. Durch Fortschritte bei der Erbgut-Sequenzierung war es nun möglich, jeden Tumor einzeln zu charakterisieren. Sobald typische Erkennungsmerkmale auf den Tumorzellen bekannt waren, ließ sich mit mRNA ein individualisierter Impfstoff herstellen. Für jeden einzelnen Patienten und sogar für jeden Tumor. Und das innerhalb weniger Wochen.
Tumor-Steckbriefe für das Immunsystem
Das funktioniert so: Zunächst suchen die Mediziner nach genetischen Besonderheiten im Erbgut der Tumorzellen. So können sie bestimmen, welche besonderen Merkmale die Tumorzellen besitzen. Die Baupläne für diese persönlichen Erkennungsmerkmale lassen sich auf mRNA schreiben und in die Körperzellen einschleusen, wie bei einer Impfung. Brossart:
„Ich glaube, dass wir effiziente Methoden schon haben, über die man RNA in den Körper bringen kann. Das haben ja durch die Pandemie diese ganzen Vakzinierungen zeigen können, dass sie schnell sind, dass sie effizient sind und dass sie auch sicher sind. Das wird auch der Weg sein bei der Krebstherapie.“
Nach den Konstruktionsplänen auf der mRNA produzieren die Körperzellen die Erkennungsstrukturen des Tumors. Die funktionieren wie Steckbriefe. Das Immunsystem lernt die Oberfläche des Tumors kennen, und kann die Tumorzellen gezielt bekämpfen.
„Nun ist es aber so, dass eine Immunantwort gegen ein Virus zu machen oder eine Impfung sehr viel einfacher ist als eine Impfung oder eine effiziente Therapie gegen Krebs. Das liegt daran, dass unser Immunsystem über Millionen von Jahren so entwickelt wurde, dass es Viren oder andere Pathogene als fremd erkennt und möglichst schnell eliminiert. Bei den Tumorzellen ist es aber so, dass die schon viele Jahre im Körper vorhanden sind und sich ständig mit dem Immunsystem auseinandergesetzt haben.“
„Ich glaube, dass wir effiziente Methoden schon haben, über die man RNA in den Körper bringen kann. Das haben ja durch die Pandemie diese ganzen Vakzinierungen zeigen können, dass sie schnell sind, dass sie effizient sind und dass sie auch sicher sind. Das wird auch der Weg sein bei der Krebstherapie.“
Nach den Konstruktionsplänen auf der mRNA produzieren die Körperzellen die Erkennungsstrukturen des Tumors. Die funktionieren wie Steckbriefe. Das Immunsystem lernt die Oberfläche des Tumors kennen, und kann die Tumorzellen gezielt bekämpfen.
„Nun ist es aber so, dass eine Immunantwort gegen ein Virus zu machen oder eine Impfung sehr viel einfacher ist als eine Impfung oder eine effiziente Therapie gegen Krebs. Das liegt daran, dass unser Immunsystem über Millionen von Jahren so entwickelt wurde, dass es Viren oder andere Pathogene als fremd erkennt und möglichst schnell eliminiert. Bei den Tumorzellen ist es aber so, dass die schon viele Jahre im Körper vorhanden sind und sich ständig mit dem Immunsystem auseinandergesetzt haben.“
Impfung als zusätzliche Option in der Krebstherapie
Tumoren sind körpereigene Gewebe und können sich viel besser vor dem Immunsystem schützen als Viren. Außerdem: Jeder Tumor ist anders. Selbst innerhalb des Tumors gibt es Unterschiede. Und als ob das nicht genug wäre: Tumoren verändern sich dauernd.
Deshalb muss eine Krebsimpfung das Immunsystem auf möglichst viele Erkennungsstellen aufmerksam machen, sodass immer noch ein paar übrig bleiben, falls der Tumor ausweicht. Peter Brossart:
„Ich habe gelernt, dass die Fortschritte, die wir erzielen, langsam vor sich gehen und häufig Zeit brauchen. Es wird eine zusätzliche Therapieoption sein. Wir hoffen, dass wir dann ein paar mehr Menschen helfen können und auch ein paar mehr Menschen heilen können.“
Eventuell muss die RNA-Impfung gegen den Tumor kombiniert werden mit einer Chemotherapie. Oder mit einer anderen Immuntherapie, wie den äußerst erfolgreichen Checkpoint-Inhibitoren. Trotz einiger Rückschläge ist Peter Brossart überzeugt: Das Konzept der Immuntherapie gegen Krebs wird sich weiterentwickeln, auch dank einer Impfung mit mRNA.
„Dieser Hype wird sich auch wieder legen. Aber was das Gute ist: Damals war das alles aus der Akademie, aus der Universität getrieben. Und da hast du nicht dieses Geld, diese Power, um das durchzusetzen. Jetzt haben wir relativ große Firmen, die wahnsinnig viel Geld verdient haben. Und die haben jetzt die Mittel, um diese Studien durchzuziehen. Da werden ein paar in die Hose gehen. Klar. Aber die werden das bis zu Ende führen.“
„Ich habe gelernt, dass die Fortschritte, die wir erzielen, langsam vor sich gehen und häufig Zeit brauchen. Es wird eine zusätzliche Therapieoption sein. Wir hoffen, dass wir dann ein paar mehr Menschen helfen können und auch ein paar mehr Menschen heilen können.“
Eventuell muss die RNA-Impfung gegen den Tumor kombiniert werden mit einer Chemotherapie. Oder mit einer anderen Immuntherapie, wie den äußerst erfolgreichen Checkpoint-Inhibitoren. Trotz einiger Rückschläge ist Peter Brossart überzeugt: Das Konzept der Immuntherapie gegen Krebs wird sich weiterentwickeln, auch dank einer Impfung mit mRNA.
„Dieser Hype wird sich auch wieder legen. Aber was das Gute ist: Damals war das alles aus der Akademie, aus der Universität getrieben. Und da hast du nicht dieses Geld, diese Power, um das durchzusetzen. Jetzt haben wir relativ große Firmen, die wahnsinnig viel Geld verdient haben. Und die haben jetzt die Mittel, um diese Studien durchzuziehen. Da werden ein paar in die Hose gehen. Klar. Aber die werden das bis zu Ende führen.“

Hartnäckigkeit der Pioniere hat sich gelohnt
Die mRNA-Impfung gegen Krebs hat heute bessere Chancen als jemals zuvor. Der Durchbruch kam mit einer erfolgreichen Impfung gegen ein Virus, das vor zwei Jahren kaum jemand kannte. Die Hartnäckigkeit der Pioniere hat sich gelohnt.
Ein später Erfolg auch für Ingmar Hoerr. Es hätte eine Genugtuung werden können, für ihn und sein Tübinger Start-Up Curevac. Doch im Frühjahr 2020 überschlugen sich die Ereignisse.
„Es war aber dann doch so, dass ich extrem unter Druck geraten bin, weil ich vor hatte mit meiner Familie eine Weltumseglung zu machen. Wir hatten das Boot schon gekauft und so weiter. Ich wollte eigentlich aus dem operativen Geschäft raus. Und jetzt war das Gegenteil der Fall, sodass ich gebeten wurde vom Aufsichtsrat, die CEO, also die Unternehmens-Chef-Stelle zu übernehmen. Als ich dann in Berlin war, war es wohl so, dass es über Nacht zu viel war und dann diese Hirnblutung aufgetreten ist.“
Ingmar Hoerr lag im Koma, während alle Welt in der Pandemie nach Impfstoffen suchte. Inzwischen hat er sich erholt. „Mir geht es erstaunlich gut. Unkraut vergeht nicht. Ich bin ein alter Kämpfer, habe immer gekämpft. Und für mich ist ganz klar, dass wir eine Weltumseglung machen wollen. Die Frage ist nur, wann.“
Seine Idee einer mRNA-Therapie gegen unterschiedliche Krankheiten geht unterdessen eigene Wege.
„Es war aber dann doch so, dass ich extrem unter Druck geraten bin, weil ich vor hatte mit meiner Familie eine Weltumseglung zu machen. Wir hatten das Boot schon gekauft und so weiter. Ich wollte eigentlich aus dem operativen Geschäft raus. Und jetzt war das Gegenteil der Fall, sodass ich gebeten wurde vom Aufsichtsrat, die CEO, also die Unternehmens-Chef-Stelle zu übernehmen. Als ich dann in Berlin war, war es wohl so, dass es über Nacht zu viel war und dann diese Hirnblutung aufgetreten ist.“
Ingmar Hoerr lag im Koma, während alle Welt in der Pandemie nach Impfstoffen suchte. Inzwischen hat er sich erholt. „Mir geht es erstaunlich gut. Unkraut vergeht nicht. Ich bin ein alter Kämpfer, habe immer gekämpft. Und für mich ist ganz klar, dass wir eine Weltumseglung machen wollen. Die Frage ist nur, wann.“
Seine Idee einer mRNA-Therapie gegen unterschiedliche Krankheiten geht unterdessen eigene Wege.
(Wiederholung der Sendung vom 24.4.2022)