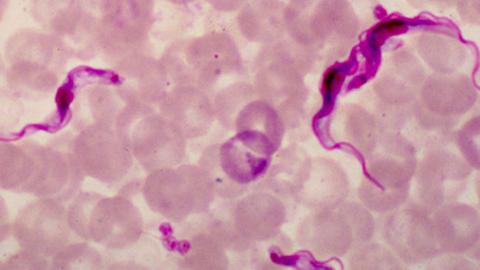
Trypanosoma brucei, der Erreger der Schlafkrankheit, lebt im Tier oder Menschen wie im Schlaraffenland. Denn im Säugetierblut schwimmt der Parasit buchstäblich in allem, was er für seinen Stoffwechsel braucht. Zum Beispiel das Kohlenhydrat Glukose, das er benötigt, um sich gegen Sauerstoffradikale zur Wehr zu setzen. Denn aus Glukose stellt Trypanosoma das Ko-Enzym NADPH her, das ihn vor den aggressiven Sauerstoffverbindungen schützt.
Doch dann die Vertreibung aus dem Paradies: Wenn eine Tsetse-Fliege ein Tier oder einen Menschen sticht, in dem sich der Parasit vermehrt hat, saugt das Insekt mit ein paar Tropfen Blut auch den Krankheitserreger auf. Danach beginnen für den Parasiten harte Zeiten: In der Fliege gerät er in ein geradezu lebensfeindliches Milieu, sagt Stefan Allmann, der an der Ludwig-Maximilians-Universität München für seine Doktorarbeit an Trypanosoma brucei forscht.
„Wir wissen, dass es in der Fliege Organe gibt, die sehr schädlich sind für Parasiten, zum einen durch sehr extreme PH-Werte oder auch eben reaktive Sauerstoffspezies. Wir sprechen vor allem vom Proventrikulus, also so einer Art Ventil vom Verdauungstrakt hin zu den Speicheldrüsen der Fliege, in die der Parasit gelangen muss, um eben übertragen werden zu können. Und Trypanosoma brucei ist sehr anfällig für reaktive Sauerstoffspezies und muss dann eben diese entgiften.“
Also muss er auch hier NADPH herstellen, doch das ist gar nicht so einfach.
„Wir wissen, dass in der Fliege wenig bis gar keine Glukose vorhanden ist.“
Wie die Forscher vom Institut für Genetik der LMU jetzt zusammen mit Kollegen aus Bordeaux und Toulouse herausgefunden haben, hat sich Trypanosoma sehr gut an die schwierige Situation in der Fliege angepasst: Es nutzt einen alternativen Weg, das Ko-Enzym zu bilden. Doch auch die Methode, die auf Glukose basiert, funktioniert bei Bedarf in der Fliege, sagt Stefan Allmann.
„Wir haben dann aber auch zu unserer Überraschung festgestellt, dass, obwohl keine Glukose vorhanden ist, trotzdem der glukoseabhängige Weg aktiv ist und zur Entgiftung von reaktiven Sauerstoffspezies beitragen kann.“
Der Parasit stellt die Glukose – oder genauer gesagt die Glukosevorstufe, die er benötigt – einfach selbst her.
„Im wesentlichen reichen ihm dazu Aminosäuren, die er dann in kleinere Kohlenstoffgerüste zerlegt, um sie dann eben zu Glukose-6-Phosphat wieder am Ende zusammenzubringen. Das ist im Prinzip genau der revertierte Ablauf des Glukose-Abbaus, einige Enzyme sind reversibel und können die Schritte, die sie in die eine Richtung katalysieren eben, auch in die andere Richtung katalysieren, und das ist in diesem Parasiten der Fall, dass sie das können.“
Die Ergebnisse zeigen, wie flexibel sich Trypanosoma brucei anpassen kann, sagt Professor Michael Boshart vom Institut für Genetik am Biozentrum der LMU München.
„Entscheidend ist, dass hier es eben diese völlig sich ergänzenden redundanten Wege gibt, dies zu produzieren, was dem Organismus es ermöglicht, sich halt in dieser flexiblen Weise anzupassen an seine Umgebung, die ihm unterschiedliche Nährstoffe zur Verfügung stellt. Und je nach Angebot benutzt er den einen oder den anderen Weg bevorzugt, um das zusammenzubauen, was er wirklich braucht.“
Die neuen Erkenntnisse helfen, den Stoffwechsel des Parasiten besser zu verstehen. Seine Flexibilität muss auch bei der Entwicklung von Strategien zur Bekämpfung der Schlafkrankheit berücksichtigt werden.
„Das jetzt vorher genau zu kennen und zu wissen, welche Möglichkeiten des Entkommens der Stoffwechsel hat, ist entscheidend, um die richtige Strategie zu wählen, wo man blockiert, sodass man eben dem Erreger keine Ausweichmöglichkeiten mehr erlaubt.“
Doch dann die Vertreibung aus dem Paradies: Wenn eine Tsetse-Fliege ein Tier oder einen Menschen sticht, in dem sich der Parasit vermehrt hat, saugt das Insekt mit ein paar Tropfen Blut auch den Krankheitserreger auf. Danach beginnen für den Parasiten harte Zeiten: In der Fliege gerät er in ein geradezu lebensfeindliches Milieu, sagt Stefan Allmann, der an der Ludwig-Maximilians-Universität München für seine Doktorarbeit an Trypanosoma brucei forscht.
„Wir wissen, dass es in der Fliege Organe gibt, die sehr schädlich sind für Parasiten, zum einen durch sehr extreme PH-Werte oder auch eben reaktive Sauerstoffspezies. Wir sprechen vor allem vom Proventrikulus, also so einer Art Ventil vom Verdauungstrakt hin zu den Speicheldrüsen der Fliege, in die der Parasit gelangen muss, um eben übertragen werden zu können. Und Trypanosoma brucei ist sehr anfällig für reaktive Sauerstoffspezies und muss dann eben diese entgiften.“
Also muss er auch hier NADPH herstellen, doch das ist gar nicht so einfach.
„Wir wissen, dass in der Fliege wenig bis gar keine Glukose vorhanden ist.“
Wie die Forscher vom Institut für Genetik der LMU jetzt zusammen mit Kollegen aus Bordeaux und Toulouse herausgefunden haben, hat sich Trypanosoma sehr gut an die schwierige Situation in der Fliege angepasst: Es nutzt einen alternativen Weg, das Ko-Enzym zu bilden. Doch auch die Methode, die auf Glukose basiert, funktioniert bei Bedarf in der Fliege, sagt Stefan Allmann.
„Wir haben dann aber auch zu unserer Überraschung festgestellt, dass, obwohl keine Glukose vorhanden ist, trotzdem der glukoseabhängige Weg aktiv ist und zur Entgiftung von reaktiven Sauerstoffspezies beitragen kann.“
Der Parasit stellt die Glukose – oder genauer gesagt die Glukosevorstufe, die er benötigt – einfach selbst her.
„Im wesentlichen reichen ihm dazu Aminosäuren, die er dann in kleinere Kohlenstoffgerüste zerlegt, um sie dann eben zu Glukose-6-Phosphat wieder am Ende zusammenzubringen. Das ist im Prinzip genau der revertierte Ablauf des Glukose-Abbaus, einige Enzyme sind reversibel und können die Schritte, die sie in die eine Richtung katalysieren eben, auch in die andere Richtung katalysieren, und das ist in diesem Parasiten der Fall, dass sie das können.“
Die Ergebnisse zeigen, wie flexibel sich Trypanosoma brucei anpassen kann, sagt Professor Michael Boshart vom Institut für Genetik am Biozentrum der LMU München.
„Entscheidend ist, dass hier es eben diese völlig sich ergänzenden redundanten Wege gibt, dies zu produzieren, was dem Organismus es ermöglicht, sich halt in dieser flexiblen Weise anzupassen an seine Umgebung, die ihm unterschiedliche Nährstoffe zur Verfügung stellt. Und je nach Angebot benutzt er den einen oder den anderen Weg bevorzugt, um das zusammenzubauen, was er wirklich braucht.“
Die neuen Erkenntnisse helfen, den Stoffwechsel des Parasiten besser zu verstehen. Seine Flexibilität muss auch bei der Entwicklung von Strategien zur Bekämpfung der Schlafkrankheit berücksichtigt werden.
„Das jetzt vorher genau zu kennen und zu wissen, welche Möglichkeiten des Entkommens der Stoffwechsel hat, ist entscheidend, um die richtige Strategie zu wählen, wo man blockiert, sodass man eben dem Erreger keine Ausweichmöglichkeiten mehr erlaubt.“