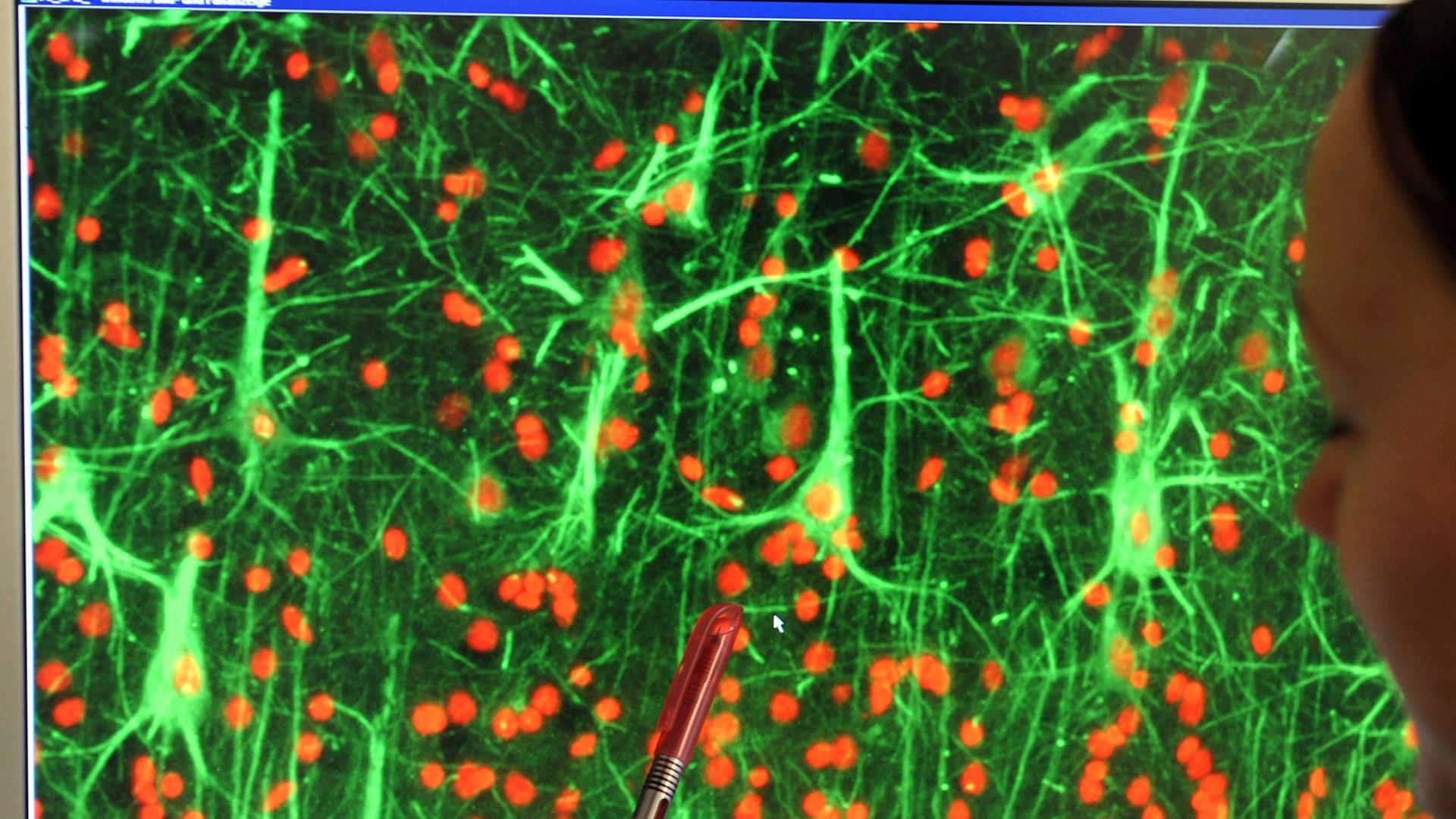
Ehud Gazit von der Universität in Tel Aviv ist kein Arzt, er ist Nanoforscher, will verstehen, wie sich die gefährlichen klebrigen Ablagerungen, die Amyloide bilden. Als Grundlagenforscher ging er systematisch vor. Arbeitete er zunächst mit natürlichen Amyloiden, die aus Eiweißen von ein paar Dutzend Aminosäuren bestehen, experimentierte er bald mit Fünfer- Aminosäuren, mit Aminosäure-Paaren und schließlich mit der reinen Aminosäure Phenylalanin, die normalerweise ein Bestandteil von Eiweißen ist.
"Das ganze begann als Kontrollexperiment. Und wir sahen, bei sehr hohen Konzentrationen begann Phenylalanin genau die gleichen klebrigen Strukturen zu bilden, wie die natürlichen Proteine. Das zeigt, nicht nur Proteine bilden Amyloide, auch andere Biomoleküle sind dazu in der Lage."
Giftig für die Nervenzellen
Konkret hat die Arbeitsgruppe inzwischen verschiedene Aminosäuren und Nukleotide getestet. Letztere sind Grundbausteine der DNA und RNA und wie die Aminosäuren normale Bestandteile des Stoffwechsels. Unter bestimmten Bedingungen bilden sie die typischen langen Fasern, aus denen auch die krankhaften Amyloide bestehen. Sie lassen sich mit denselben Farbstoffen sichtbar machen und selbst ihre Feinstruktur ist vergleichbar. Die einzelnen Aminosäuren ordnen sich in den Fasern so zusammen an, wie sie es ansonsten fest gebunden in den Amyloidproteinen tun. Damit bilden diese Stoffwechselbestandteile physikalisch und chemisch gesehen ganz klar Amyloide. Entscheidend ist aber letztlich die biologische Ebene.
"Hier sehen wir genau dieselben Effekte wie bei den natürlichen Amyloiden. Sie sind giftig für Nervenzellen, und mehr noch, sie lösen genau wie die anderen Amyloide den programmierten Zelltod aus."
Geistige Entwicklungsstörungen
Die Amyloide entstehen erst bei sehr hohen Konzentrationen. Im Normalbereich sind Phenylalanin, Cystein, Adenin oder Uracil verträgliche, ja mehr noch lebensnotwendige Substanzen. Man könnte diese Amyloidbildung durch Stoffwechselmoleküle also als Reagenzglaseffekt abtun, interessant - doch ohne weitere Bedeutung. Aber, betont Ehud Gazit, es gibt auch in der Natur seltene Umstände, in denen solch hohe Konzentrationen erreicht werden. Am bekanntesten ist die Erbkrankheit Phenylketonurie. Heute wird jedes Baby direkt nach der Geburt auf PKU getestet. Eines unter etwa 8.000 hat die Krankheit und muss dann lebenslang eine sehr strenge Diät ohne jedes Eiweiß und damit ohne Phenylalanin einhalten. Denn sonst sammelt sich die Aminosäure an, und es kommt zu geistigen Entwicklungsstörungen.
"Früher hat man gedacht, dass liegt an einem Ungleichgewicht der Aminosäuren im Stoffwechsel. Aber unter diesen Bedingungen können auch diese amyloidähnlichen Strukturen entstehen, genau wie bei Alzheimer oder Parkinson. Diese Amyloide lassen sich bei Tiermodellen der PKU nachweisen und sogar im Gehirn von verstorbenen Patienten. Das verändert wirklich den Blick auf die erblichen Stoffwechselstörungen."
Frühe Diagnose und strikte Diät
Es gibt rund 50 dieser Erbkrankheiten, bei denen sich jeweils ein anderes kleines Molekül in großen Mengen ansammelt, weil es die Zellen weder abbauen noch weiterverarbeiten können. Ehud Gazit nimmt an, dass sich irgendwann aus den Stoffwechselabfällen Amyloide bilden, die dann in unterschiedlichen Organen und Geweben die Zellen schädigen und so letztlich die Symptome verursachen. Bislang ist es ihm gelungen, für sechs dieser Krankheiten die Amlyoidbildung im Reagenzglas nachzuweisen. Dort ist es auch möglich, diesen Prozess mit Medikamenten zu blockieren. Nach wie vor ist eine frühe Diagnose und dann eine strikte Diät allerdings die beste Therapie.
"Diese Patienten dürfen keinerlei Eiweiße essen, weder von Tieren noch von Pflanzen. Es ist sehr schwer, das einzuhalten. Und selbst wenn es gelingt, sieht man kleine Probleme, wenn sich lokal eben doch Aminosäuren anhäufen, die essenziell für den Körper sind."
In Zukunft, so hofft Ehud Gazit, könnten hier Medikamente gegen die Amyloidbildung eine wertvolle Unterstützung zur strikten Diät bilden. Die ersten Tierversuche werden demnächst beginnen, doch bis ein wirksames Medikament auf den Markt kommt, werden sicher noch viele Jahre vergehen.