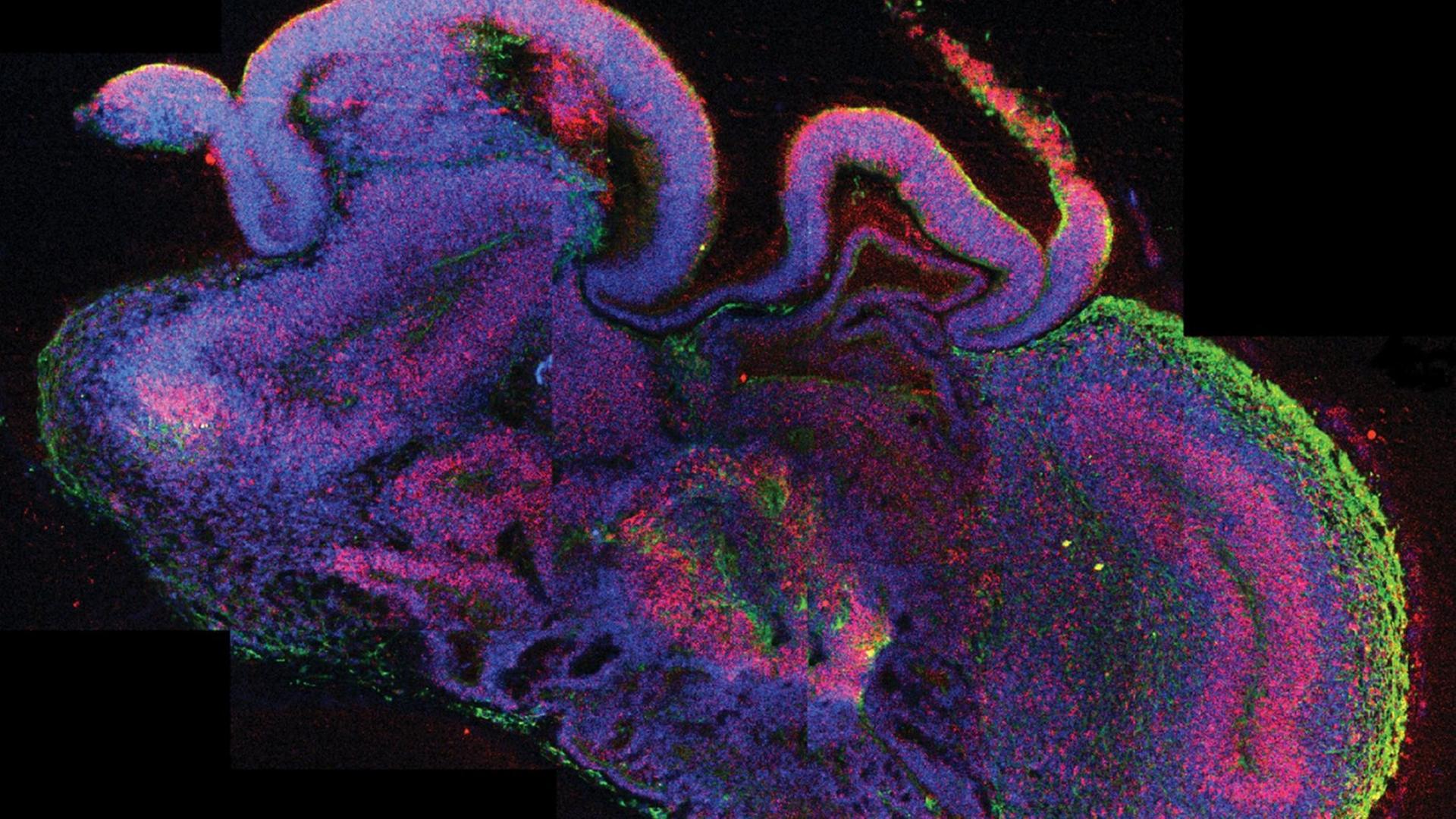
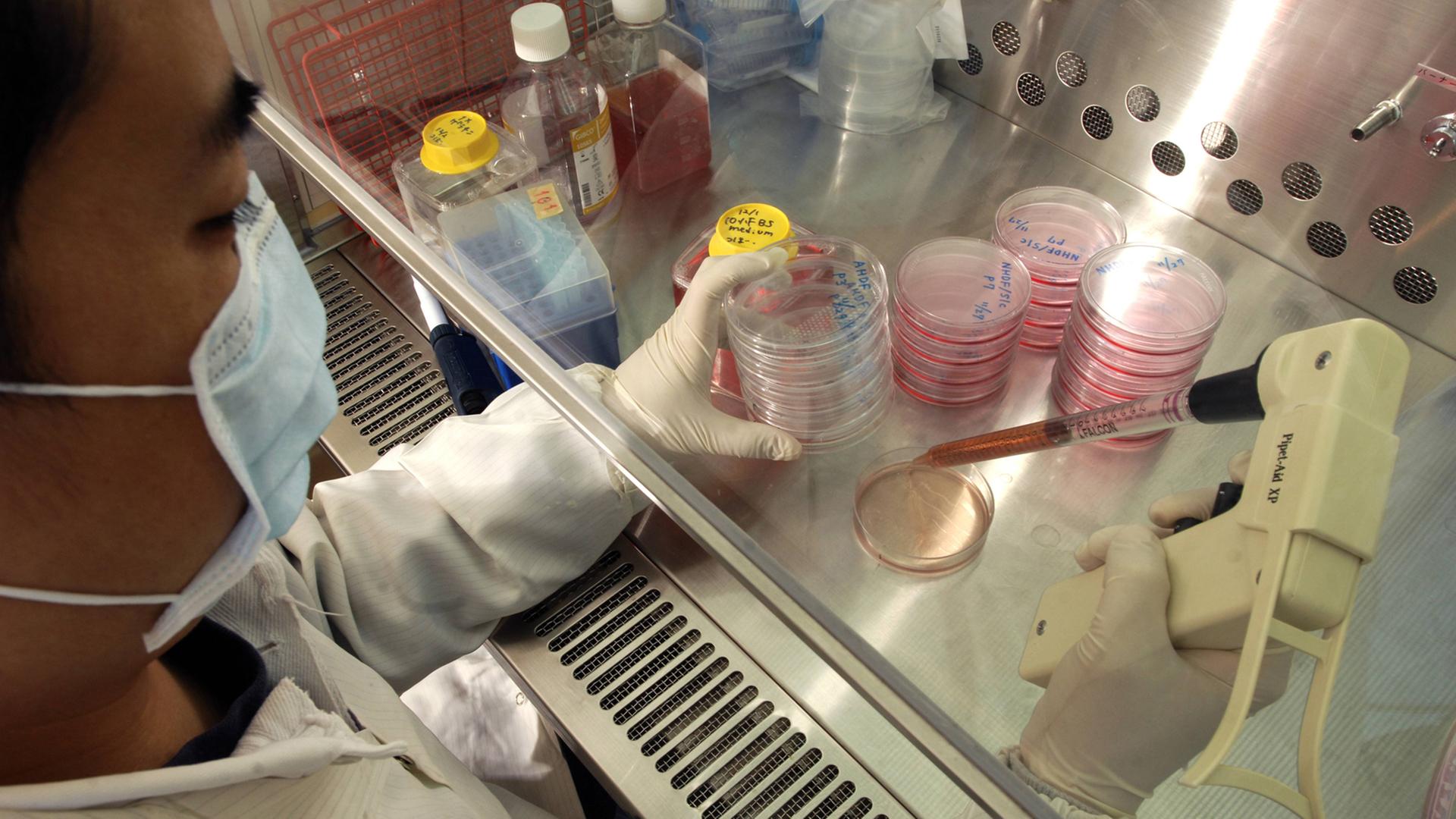
Menschliche Embryonale Stammzellen. Anfang der 2.000er-Jahre war das eine Art Zauberwort der Wissenschaft. Ganze neuartige ES-Zell-Therapien für Alzheimer, Herzinfarkt oder Querschnittslähmung schienen greifbar. Aber es dauerte und dauerte. Inzwischen gibt es aber doch eine Bewegung vom Labor in Richtung Anwendung. Die Genehmigung der ersten klinischen Studie zum Einsatz von zu ES-Zellen bei Rückenmarkverletzungen in den USA benötigte sechs Jahre, der Antrag umfasste 21.000 Seiten. Die Hürden sind also hoch. Aber heute gibt es weltweit etwa 30 Studien, vor allem zu Augenerkrankungen, aber auch zu Parkinson, Diabetes, Herzinfarkt und der Querschnittlähmung. Bei den meisten geht es um die Sicherheit der Zelltherapien, und die ersten Ergebnisse stimmen Peter Löser zuversichtlich:
"Weder die erwarteten noch unerwartete Nebenwirkungen sind bisher aufgetreten. Im Falle der Behandlung von Augenerkrankungen hat man sogar erste sehr ermutigende therapeutische Effekte beobachten können bei einigen Patienten und man wird sehen, was die Zeit bringt."
Bisher nur Labor-Experimente in Deutschland
Studien an Patienten haben in Deutschland noch nicht begonnen, aber es gibt 117 Labor-Experimente mit menschlichen ES-Zellen. Diese embryonalen Stammzelllinien wurden alle vor dem 1. Mai 2007 im Ausland hergestellt. Das verlangt das Stammzellgesetz. Peter Löser vom Robert Koch Institut in Berlin ist in Deutschland für die Genehmigung dieser Experimente zuständig. Für ihn ist besonders ein Aspekt des Gesetzes problematisch.:
"An humanen embryonalen Stammzellen kann geforscht werden. Aber wenn die Forschung abgeschlossen ist, können Sie humane embryonale Stammzellen nicht nutzen, um routinemäßig für die breite Anwendung Zelltherapeutika herzustellen und sie dann in der Praxis anzuwenden."
"Forschungsbeschränkungen verfassungswidrig"
Der Bericht der Berlin-Brandenburgische Akademie der Wissenschaften fordert eine Überarbeitung des Stammzellgesetzes. Jochen Taupitz, ehemaliger Vorsitzender des Deutschen Ethikrats und Spezialist für das Medizinrecht, sagt sogar:
"Aus meiner Sicht sind eine ganze Reihe der Forschungsbeschränkungen des Stammzellgesetzes verfassungswidrig."
Vor allem weil es ja nicht um die Nutzung der Embryonen selbst geht, sondern um aus ihnen entwickelte Zelllinien. Ob sich der Bundestag von diesem Argument überzeugen lässt, bleibt abzuwarten. Einige deutsche Forscher setzten deshalb auf die sogenannten induzierten pluripotenten Stammzellen. Diese IPS-Zellen werden mit genetischen Tricks zum Beispiel aus Hautzellen entwickelt. Weil dabei kein Embryo zerstört wird, gelten IPS-Zellen als ethisch unproblematisch. Trotzdem kann sich nicht die ganze Forschung auf die induzierten pluripotenten Stammzellen konzentrieren, sagt Martin Zenke vom Universitätsklinikum Aachen und Herausgeber des Berichts Stammzellforschung der BBAW:
"Das wäre sicherlich zu kurz gesprungen, zu kurz gedacht. Beide Zelltypen haben ihre Berechtigung sowohl in der Forschung wie auch in der Therapie einer möglichen therapeutischen Anwendung."
Vor allem weil es ja nicht um die Nutzung der Embryonen selbst geht, sondern um aus ihnen entwickelte Zelllinien. Ob sich der Bundestag von diesem Argument überzeugen lässt, bleibt abzuwarten. Einige deutsche Forscher setzten deshalb auf die sogenannten induzierten pluripotenten Stammzellen. Diese IPS-Zellen werden mit genetischen Tricks zum Beispiel aus Hautzellen entwickelt. Weil dabei kein Embryo zerstört wird, gelten IPS-Zellen als ethisch unproblematisch. Trotzdem kann sich nicht die ganze Forschung auf die induzierten pluripotenten Stammzellen konzentrieren, sagt Martin Zenke vom Universitätsklinikum Aachen und Herausgeber des Berichts Stammzellforschung der BBAW:
"Das wäre sicherlich zu kurz gesprungen, zu kurz gedacht. Beide Zelltypen haben ihre Berechtigung sowohl in der Forschung wie auch in der Therapie einer möglichen therapeutischen Anwendung."
Vorteile der IPS-Zellen
Vor allem auch, weil es bislang nur vier klinische Studien zu IPS-Zellen gibt. Ihr therapeutisches Potenzial ist also noch weniger ausgelotet als das der embryonalen Stammzellen. Theoretisch haben induzierte pluripotente Stammzellen allerdings einen großen Vorteil: Sie können für jeden Patienten aus dessen eigenen Zellen entwickelt werden. Eine Gewebeabstoßung wäre also ausgeschlossen. Bei der vorerst einzigen individuellen IPS-Zell-Behandlung kostete allerdings allein die Zulassung der Zellen rund eine Million Dollar.
Für die breite Anwendung wird es wohl auf eine Stammzelltherapie von der Stange herauslaufen. In Deutschland soll die erste klinische Studie mit IPS-Zellen 2019 starten. Der Herzspezialist Wolfram Zimmermann von der Universitätsmedizin Göttingen konnte schon zeigen, dass seine Herzzellen aus dem Labor bei Ratten die Folgen eines Herzinfarktes abmildern können. Für die geplante Studie an 20 Patienten muss er allerdings in anderen Dimensionen denken und Milliarden von Zellen unter Reinstraumbedingungen züchten.
"Wir haben 2016 bereits zeigen können, dass es geht. Wir haben 18 Milliarden Zellen bei uns im Labor hergestellt unter sehr kontrollierten Bedingungen. Also im Prinzip ist das alles machbar."
Grundlagenforschung beginnt sich auszuzahlen
Nach und nach beginnt sich die Grundlagenforschung an den embryonalen Stammzellen und den IPS-Zellen auszuzahlen. Es gibt eine Bewegung hin zur Behandlung von Patienten in klinischen Studien. Die ersten soliden Ergebnisse erwartet Peter Löser bei den Therapien für Augenerkrankungen:
"Also in dem Bereich rechne ich zuerst auch mit tatsächlich breiterer klinischer Anwendung. Ob das auf der Basis von ES- oder IPS-Zellen erfolgt, das kann man heute noch gar nicht sagen. Klinische Studien gibt es mit beiden Zelltypen. Entscheidend ist letztlich, dass das Produkt, das hier zum Einsatz kommt, sicher und effektiv ist."
Im Fazit des Berichts Stammzellforschung fordert die Berlin-Brandenburgischen Akademie der Wissenschaften eine weitere Förderung der Stammzellforschung und eine Anpassung der gesetzlichen Rahmenbedingungen in Deutschland, damit aus dem Versprechen der Embryonalen Stammzellen und der iPS-Zellen in absehbarer Zeit verlässliche Therapien für die Patienten werden.
"Also in dem Bereich rechne ich zuerst auch mit tatsächlich breiterer klinischer Anwendung. Ob das auf der Basis von ES- oder IPS-Zellen erfolgt, das kann man heute noch gar nicht sagen. Klinische Studien gibt es mit beiden Zelltypen. Entscheidend ist letztlich, dass das Produkt, das hier zum Einsatz kommt, sicher und effektiv ist."
Im Fazit des Berichts Stammzellforschung fordert die Berlin-Brandenburgischen Akademie der Wissenschaften eine weitere Förderung der Stammzellforschung und eine Anpassung der gesetzlichen Rahmenbedingungen in Deutschland, damit aus dem Versprechen der Embryonalen Stammzellen und der iPS-Zellen in absehbarer Zeit verlässliche Therapien für die Patienten werden.