Am Freitag (29.01.2021) entscheidet die Europäische Arzneimittel-Agentur (EMA) darüber, ob und in welcher Form sie eine Zulassung des Impfstoffs des britisch-schwedischen Pharmakonzerns AstraZeneca empfehlen wird. Es geht um einen klassisch hergestellten Impfstoff, den die Oxford University gemeinsam mit AstraZeneca entwickelt hat.
Seit Tagen gibt es jedoch Streit zwischen der EU-Kommission und dem Konzern. Denn der hat vor einer Woche – sehr kurzfristig – bekannt gegeben, dass die vertraglich vereinbarten Impfstoffmengen nicht geliefert werden können. Nur etwa 40 Prozent der in Aussicht gestellten Mengen sollen im ersten Quartal 2021 verfügbar sein. Offenbar gibt es Probleme in einem Werk in Belgien und das Argument, Großbritannien habe zuerst bestellt und müsse darum auch zuerst beliefert werden. Der Streit wird seit Tagen öffentlich ausgetragen, Gespräche wurden angesetzt, verschoben und dann doch geführt und nun scheint es langsam einen gemeinsamen Nenner zu geben. Allerdings nur unter großem Druck der EU-Kommission.
Kommissionspräsidentin Ursula von der Leyen will den Vertrag mit AstraZeneca nun öffentlich machen, um zu belegen, dass der Konzern eindeutige Verpflichtungen mit der EU eingegangen ist. Im Vertrag sei ausdrücklich versichert worden, dass "keine anderen Verpflichtungen einer Erfüllung des Vertrages entgegenstünden", so von der Leyen. Im Dlf forderte sie von AstraZeneca "Transparenz und Planungssicherheit" und "eine plausible Erklärung" für die Lieferschwierigkeiten.
Das ganze Interview im Wortlaut:
Dirk-Oliver Heckmann: Hand aufs Herz, Frau von der Leyen. Wie sauer sind Sie auf AstraZeneca und den Chef des Unternehmens, Pascal Soriot?
Ursula von der Leyen: Im Grundsatz muss uns allen immer wieder klar sein: Unser Gegner ist das Virus und die Pharmaunternehmen sind Teil der Lösung. Und ich muss sagen, ich mache sehr, sehr gute Erfahrungen mit den Pharmaunternehmen, mit denen wir zusammenarbeiten, BioNTech zum Beispiel, Moderna.
Hier bei AstraZeneca, was ich verlange, ist Transparenz und Planungssicherheit. Wir haben wie in alle anderen Pharmaunternehmen dreistellige Millionenbeträge investiert, früh im letzten Sommer und Herbst in diese Unternehmen, dass sie ihre Kapazitäten ausbauen. Das war alles auf Risiko, weil niemand wusste, welches Unternehmen tatsächlich einen Impfstoff dann auch entwickeln wird. Wir stellen fest, dass wir auf die richtigen Unternehmen gesetzt haben, denn alle die, die heute international erfolgreich sind mit Impfstoffen, sind auch bei uns unter Vertrag. Aber wir wollen, dass bei AstraZeneca wie bei den anderen Unternehmen dann auch die Lieferzusagen erfüllt werden, und das ist genau der Punkt, mit dem wir mit dem Unternehmen jetzt diskutieren. Da möchten wir Transparenz, wir möchten Planungssicherheit. Die Landräte, die Gesundheitsämter, alle brauchen ihre Planung für ihre Impfstrategien und das muss das Unternehmen jetzt leisten.
"Wichtig, dass wir diesen Vertrag jetzt öffentlich machen"
Heckmann: Und auch die Bürgerinnen und Bürger natürlich. Die warten darauf, das ist ja auch ganz klar, Ihnen natürlich auch. – Lieferzusagen ist ein gutes Stichwort. AstraZeneca sagt jetzt aber, wir haben mit der EU gar keine festen Mengen vereinbart. Alles war unter dem Vorbehalt "best effort", zu Deutsch, wir tun unser Bestes. Haben Sie, hat die EU-Kommission insofern schlecht verhandelt an dem Punkt?
von der Leyen: "Best effort" gilt, solange nicht klar war, ob sie einen Impfstoff entwickeln können. Diese Zeit haben wir jetzt hinter uns. Der Impfstoff ist da. Er muss jetzt noch durch die endgültige Prüfung. Mit der Entwicklung eines Impfstoffes, der wirkt und der sicher ist, gibt es dann ganz klare Liefermengen, sowohl für den Dezember des letzten Jahres als auch für die Quartale, das erste, zweite und dritte Quartal. Die stehen im Vertrag. Und es gibt Produktionsstandorte, die diese Liefermengen auch dann produzieren sollen. Deshalb ist uns nach den Äußerungen des Vorstandsvorsitzenden in der Öffentlichkeit auch wichtig, dass wir diesen Vertrag jetzt öffentlich machen, dass dort auch die Bürgerinnen und Bürger sich Transparenz darüber verschaffen können, was im Vertrag steht.
Heckmann: Und der wird jetzt auch veröffentlicht?
von der Leyen: Wir wollen ihn heute veröffentlichen. Wir sprechen mit dem Unternehmen, welche Teile geschwärzt werden müssen. Das sind geschäftssensible Daten. Das ist klar. Aber im Grundsatz: Diese Themen, die ich eben angesprochen habe, da wollen wir Transparenz schaffen. Wir wissen genau, was in dem Vertrag steht, und deshalb ist es uns wichtig, dass der jetzt auch öffentlich gemacht wird.

"Was wir wollen, ist eine plausible Erklärung"
Heckmann: Daran haben natürlich auch viele Interesse, auch natürlich die Bürgerinnen und Bürger und die Zuhörerinnen und Zuhörer hier vom Deutschlandfunk. – Frau von der Leyen, ich wollte noch mal kurz zurückkommen. Feste Mengen vereinbart, und diese Vereinbarung, die ist nicht versehen, das sagen Sie hier im Deutschlandfunk um 7:21 Uhr, mit der Einschränkung "best effort"?
von der Leyen: Nein! Es gibt verbindliche Bestellungen und der Vertrag ist glasklar. AstraZeneca hat uns auch ausdrücklich versichert in diesem Vertrag, dass keine anderen Verpflichtungen einer Erfüllung des Vertrages entgegenstünden, und darauf kommt es uns schlicht und einfach an.
Schauen Sie, was selbstverständlich ist, ist, dass bei einer so großen Massenproduktion und Massenimpfung – das hat die Welt noch nie vorher gesehen -, bei dieser kurzfristigen Entwicklung eines Impfstoffs - - Normalerweise braucht man zehn Jahre für die Entwicklung eines Impfstoffes. Wir haben jetzt zehn Monate gebraucht, auch weil wir massiv investiert haben in Forschung ganz am Anfang der Pandemie. Da ist es völlig nachvollziehbar, das geht allen Unternehmen so, dass die Startschwierigkeiten haben. Das war bei BioNTech, das war bei Moderna. Die anderen, die kommen, da erwarte ich das auch. Das ist in Ordnung.
Was wir aber wollen, ist eine plausible Erklärung, warum diese Startschwierigkeiten da sind, und dann arbeiten wir gemeinsam daran, diese Probleme zu lösen. Das ging sehr, sehr gut mit BioNTech. Sie wissen, dass wir jetzt auch einen Zusatzvertrag bei BioNTech haben für das zweite Quartal. Das läuft alles gerade. Das ist in Ordnung, dass man diese täglichen Schwierigkeiten zusammen überwindet. Aber wir wollen Transparenz. Wir wollen wissen, was ist los.
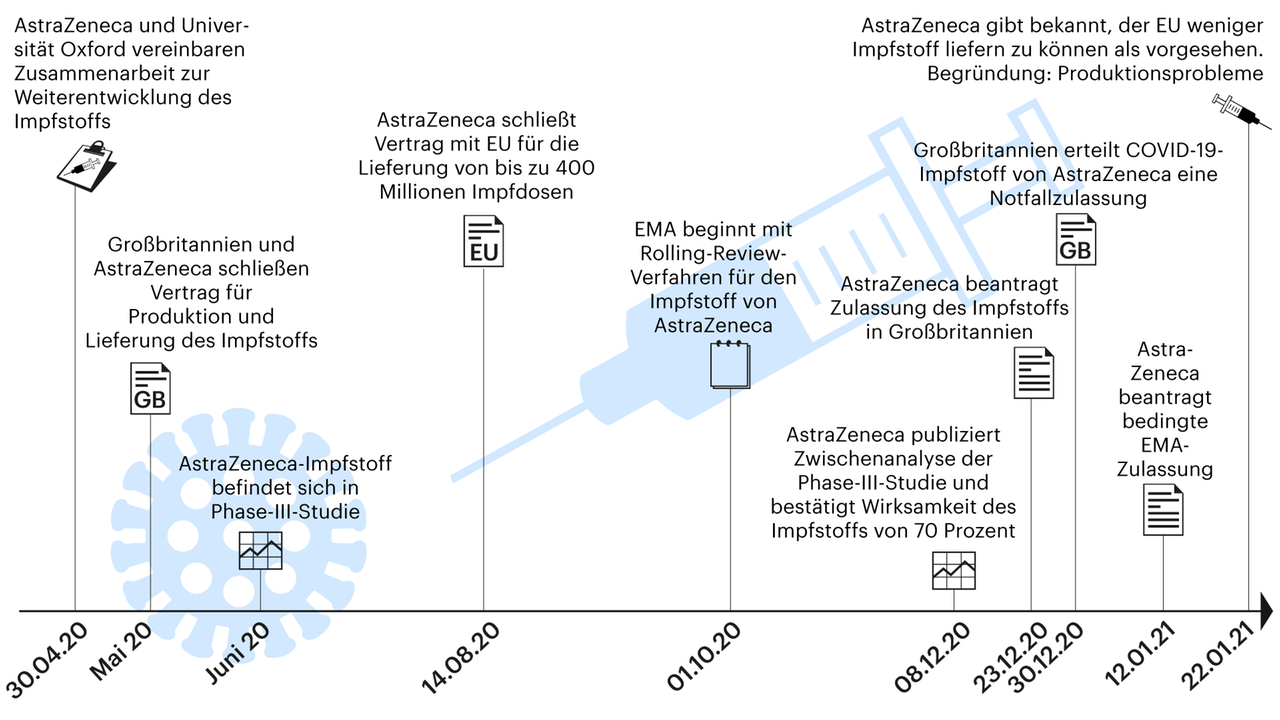
- Mai 2020: Großbritannien und AstraZeneca schließen Vertrag für Produktion und Lieferung des Impfstoffs
- Juni 2020: AstraZeneca-Impfstoff befindet sich in Phase-III-Studie
- 14. August 2020: AstraZeneca schließt Vertrag mit EU für die Lieferung von bis zu 400 Millionen Impfdosen
- 08. Dezember 2020: AstraZeneca publiziert Zwischenanalyse einer Phase-III-Studie und bestätigt Wirksamkeit des Impfstoffs von 70 Prozent (in The Lancet veröffentlicht)
- 23. Dezember 2020: AstraZeneca beantragt Zulassung des Impfstoffs in Großbritannien
- 30. Dezember 2020: Großbritannien erteilt COVID-19-Impfstoff von AstraZeneca eine Notfallzulassung
- 12. Januar 2021: AstraZeneca beantragt bedingte EMA-Zulassung
- 22. Januar 2021: AstraZeneca gibt bekannt, der EU weniger Impfstoff liefern zu können als vorgesehen. Begründung: Produktionsprobleme
"Es gibt keine Reihenfolge in dem Vertrag"
Heckmann: Startschwierigkeiten, das hat auch Pascal Soriot erwähnt in seinem Interview von vor zwei Tagen. Der hat gesagt, auch in Großbritannien hatten wir Startschwierigkeiten, die konnten aber behoben werden in der Zeit. Aber Großbritannien hat auch früher bestellt als die EU und das Problem ist, dass die EU zum gleichen Zeitpunkt beliefert werden möchte und wollte und will wie Großbritannien, obwohl die EU später dran war.
von der Leyen: Das ist genau der Punkt, den ich gerade erwähnte. Es gibt keine Reihenfolge in dem Vertrag. Es gibt keinerlei Hinweis auf eine Vorbindung, sondern der Vertrag ist eindeutig. Es gibt eine verbindliche Bestellung und keine andere Verpflichtung steht dem Vertrag entgegen. Wissen Sie, das ist nicht wie beim Bäcker, wo man Schlange steht, sondern da ist ein klarer Vertrag. Da geht es um Millionenbeträge, die vorinvestiert worden sind durch die Europäische Union. Wir haben sie investiert mit der klaren Maßgabe, baut die Produktionskapazitäten auf, die notwendig sind, solche Massenproduktionen zu machen – übrigens bei jedem dieser Pharmaunternehmen.
Wir hätten heute gar nicht die Produktionsmöglichkeiten, wenn die Europäische Union nicht diese Vorinvestitionen in diese Unternehmen getätigt hätte, auch auf das Risiko hin, dass das Unternehmen vielleicht keinen Impfstoff entwickeln kann. Dieses Risiko sind wir bewusst eingegangen, weil wir wissen, dass wir Milliarden Dosen brauchen. Die Europäische Union hat vertraglich zugesichert, insgesamt 2,3 Milliarden Impfdosen, die im Laufe der Zeit jetzt langsam aber sicher kommen werden. Sie sehen, die Grundlage stimmt. Jetzt geht es in die Details und da möchten wir bei AstraZeneca genauso die Planungssicherheit haben und die Zuverlässigkeit und Transparenz, wie wir sie bei den anderen Unternehmen haben.
"AstraZeneca hat uns im Vertrag vier Produktionsstätten genannt"
Heckmann: Im Vertrag – Sie haben es auch erwähnt – stehen vier Produktionswerke von AstraZeneca. Steht denn, Frau von der Leyen, in dem Vertrag auch drin, dass AstraZeneca aus den Werken in Großbritannien liefern muss, wenn es zu Schwierigkeiten in anderen Werken auf dem Kontinent kommt? Das heißt, hat Europa einen vertraglich fixierten Anspruch auf Lieferung aus den AstraZeneca-Werken in Großbritannien?
von der Leyen: Das Unternehmen selbst hat im Vertrag uns vier Produktionsstätten – zwei sind davon in der Tat in Großbritannien – genannt. Das war ihre Entscheidung. Sie sind diejenigen, die den Überblick über ihre Produktion haben und selbstverständlich das planen. Da stehen eindeutig die beiden Produktionsstätten aus Großbritannien auch drin. Wie sie das dann zum Schluss managen, ist die Aufgabe des Unternehmens. Aber sie haben uns angegeben, am Anfang, als es darum ging, dass sie uns auch deutlich machen, dass sie liefern können, dass wir diesen Vertrag auch abschließen können – da waren wichtige Haftungsfragen auch, die geklärt werden mussten in diesem Vertrag -, uns unter anderem auch diese Produktionsstätten gezeigt oder genannt in dem Vertrag. Die stehen dort.
Von der Leyen: Zugesagte Lieferungen wurden kurzfristig reduziert
Heckmann: Das heißt, ich verstehe Sie richtig, Frau von der Leyen, Sie fordern AstraZeneca hier und heute auf, das Unternehmen muss seine Lieferungen an Großbritannien kürzen und an Europa weitergeben?
von der Leyen: Nein! Ich fordere das Unternehmen auf, seine Lieferverpflichtung uns gegenüber zu erfüllen. Nur damit wir darüber auch klar sind: Ich verstehe, dass sie Anfangsschwierigkeiten haben. Wir möchten Plausibilität und Transparenz darüber, warum das so ist. Vielleicht können wir auch helfen. Wir möchten wissen, woran liegt es, dass ihr nicht heute erfüllen könnt, was wir im Vertrag festgeschrieben haben, nämlich, dass wir Millionen investieren bei euch, ihr dafür aber auf Lager schon vorweg produziert. Wo sind diese Dosen? Das ist die erste Frage, die wir haben.
Und zweitens: Selbstverständlich muss AstraZeneca die Impfdosen im Laufe der Zeit liefern, die vertraglich festgelegt sind.
Was uns irritiert hat – und ich sage uns, weil es die 27 Mitgliedsstaaten sind, die mit der Europäischen Kommission tagaus, tagein hier an vorderster Front auch arbeiten, damit wir diese große Impfaktion auch gemeinsam bewältigen -, was uns irritiert ist, dass AstraZeneca anders als die anderen Unternehmen ganz kurzfristig angegeben hat, nämlich vor einer Woche, dass sie drastisch reduzieren die zugesagten Lieferungen fürs erste Quartal, und uns keine nachvollziehbaren Gründe genannt haben, dass wir verstehen, woran es liegt, warum sie nicht die Dosen auf Lager abrufen können, und da möchten wir jetzt Klarheit haben.
Bedingte Marktzulassung und Notfallzulassung - die wichtigsten Unterschiede
Notfallzulassung: Sie wird nur vorübergehend - für die Zeit des Notfalls - erteilt. Das Medikament muss noch nicht zugelassen sein und die Qualitätsprüfung – z.B. auf welchem Stand Studien und Tests zu Sicherheit und Wirksamkeit des Medikaments sind – liegt im Ermessen des Staates. Im Fall einer Notfallzulassung haftet nicht das Unternehmen, sondern der Staat, der die Notfallverordnung erlassen hat.
Bedingte Marktzulassung: Sie gilt zunächst für ein Jahr. Die Prüfung des Medikaments unterliegt den Richtlinien der Europäischen Arzneimittel-Agentur (EMA). Es müssen noch nicht alle Studien, etwa zu Langzeitwirkungen, vorhanden sein. Die Unternehmen verpflichten sich jedoch, die fehlenden Studien zu einem bestimmten Zeitpunkt nachzureichen und ihre Forschung fortzusetzen. Die Haftung übernimmt im Fall einer bedingten Marktzulassung in der Regel das Unternehmen und nicht der Staat. Allerdings gibt es bei den Verträgen mit den Impfstoffherstellern Entschädigungsklauseln, die die Hersteller im Fall einer Klage auf Schadenersatz entlasten sollen. In einer Pressemitteilung der EU-Kommission zur Unterzeichnung der Verträge mit AstraZeneca heißt es: "Die Vorverträge mit den Unternehmen sehen aber Entschädigungsklauseln vor für den Fall, dass ein Hersteller zu Schadenersatzzahlungen verurteilt würde."
(Weitere Quelle: Fragen und Antworten zum BioNTech-Zulassungsverfahren)
Notfallzulassung: Sie wird nur vorübergehend - für die Zeit des Notfalls - erteilt. Das Medikament muss noch nicht zugelassen sein und die Qualitätsprüfung – z.B. auf welchem Stand Studien und Tests zu Sicherheit und Wirksamkeit des Medikaments sind – liegt im Ermessen des Staates. Im Fall einer Notfallzulassung haftet nicht das Unternehmen, sondern der Staat, der die Notfallverordnung erlassen hat.
Bedingte Marktzulassung: Sie gilt zunächst für ein Jahr. Die Prüfung des Medikaments unterliegt den Richtlinien der Europäischen Arzneimittel-Agentur (EMA). Es müssen noch nicht alle Studien, etwa zu Langzeitwirkungen, vorhanden sein. Die Unternehmen verpflichten sich jedoch, die fehlenden Studien zu einem bestimmten Zeitpunkt nachzureichen und ihre Forschung fortzusetzen. Die Haftung übernimmt im Fall einer bedingten Marktzulassung in der Regel das Unternehmen und nicht der Staat. Allerdings gibt es bei den Verträgen mit den Impfstoffherstellern Entschädigungsklauseln, die die Hersteller im Fall einer Klage auf Schadenersatz entlasten sollen. In einer Pressemitteilung der EU-Kommission zur Unterzeichnung der Verträge mit AstraZeneca heißt es: "Die Vorverträge mit den Unternehmen sehen aber Entschädigungsklauseln vor für den Fall, dass ein Hersteller zu Schadenersatzzahlungen verurteilt würde."
(Weitere Quelle: Fragen und Antworten zum BioNTech-Zulassungsverfahren)
Heckmann: Um 7:30 Uhr kommen hier die Nachrichten. Trotzdem möchte ich Sie grundsätzlich noch mal ansprechen, Frau von der Leyen, auf die Strategie der EU-Kommission. Wenn man mal auf die Zahl der Erstimpfungen schaut: In Großbritannien unter Boris Johnson, da gab es 7,6 Millionen Erstimpfungen bis jetzt. Das sind 11,3 Prozent der Bevölkerung. In Deutschland 1,7 Millionen Erstimpfungen, 2,1 Prozent. Hat sich der Brexit schon gelohnt und ist die EU-Kommission einfach zu langsam? Denn Großbritannien hat schon im August abgeschlossen, die EU-Kommission Monate später.
von der Leyen: Wir haben im August unseren "Advanced Purchase Agreement" abgeschlossen mit AstraZeneca.
"Großbritannien hat eine Notfallzulassung gemacht"
Heckmann: Das ist der Vorvertrag.
von der Leyen: Das war einer der ersten Verträge, die wir abgeschlossen haben, weil damals war AstraZeneca – Sie erinnern sich – das Unternehmen, was am vielversprechendsten war. Wir sehen zum Schluss, es ist anders gekommen, das erst mal vorweg. Die Mitgliedsstaaten haben dann ihre Bestellungen individuell aufgegeben. Seit Oktober weiß das Unternehmen genau, welche Bestellung das jeweilige Land hat.
Der Unterschied zu Großbritannien ist – und das ist ein wichtiger Punkt: Großbritannien hat eine Notfallzulassung gemacht innerhalb von 24 Stunden. Wir finden ganz wichtig bei diesen Impfstoffen, dass es keine Abkürzung bei der Sicherheit geben darf.
"Bei der Sicherheit darf man keine Abstriche machen"
Heckmann: Auch bei dieser Notlage?
von der Leyen: Dass die Unternehmen uns Daten geben müssen, wie sie die klinischen Untersuchungen gemacht haben, auch bei dieser Notlage, denn wir impfen ja eine aktive, eine biologisch aktive Substanz an gesunde Menschen. Das heißt, bei der Sicherheit darf man keine Abstriche machen. Deshalb ist es uns wichtig, wie es übrigens die Amerikaner auch machen bei AstraZeneca, dass das Unternehmen uns die Daten liefert. Das haben sie jetzt getan. Es wird heute die Zulassungsbehörde darüber entscheiden, wie zugelassen wird. Das ist ein Punkt. Diese drei, vier Wochen, die muss man sich an Zeit nehmen. Das hat große Auswirkungen auf die Sicherheit. Und wir sind entschlossen, auch diesen sicheren Weg weiterzugehen.
Äußerungen unserer Gesprächspartner geben deren eigene Auffassungen wieder. Der Deutschlandfunk macht sich Äußerungen seiner Gesprächspartner in Interviews und Diskussionen nicht zu eigen.